Toma de decisiones clínicas basadas en pruebas científicas
EVIDENCIAS EN PEDIATRÍA
Diciembre 2008. Volumen 4. Número 4
| Instrumentos para el desarrollo y uso de las Guías de práctica clínica basadas en la evidencia
Valoración: 0 (0 Votos)Autores: Guerra de Hoyos JA, Rivas Aguayo D, Ruiz-Canela Cáceres J.
 Suscripción gratuita al boletín de novedades
Suscripción gratuita al boletín de novedades
Reciba periódicamente por correo electrónico los últimos artículos publicados
Suscribirse |
Autores:
Correspondencia:
En la actualidad el proceso de la toma de decisiones en la práctica clínica se ha hecho muy complejo, ya que para la mayoría de los problemas de salud, disponemos de más de una intervención posible para proponer a nuestros pacientes. Estas pueden aportar beneficios, pero también riesgos. La adecuación - la decisión sobre si resulta correcta la indicación de una determinada intervención a un determinado paciente- es un problema de balancear los beneficios y riesgos de esa intervención. En la rutina diaria de la atención a los pacientes el médico se enfrenta a dificultades para saber cuál es la intervención más adecuada, ya que esto implica, por un lado, conocer con el mayor grado de certeza posible cuáles son los beneficios, los riesgos, los inconvenientes y los costes de las distintas opciones. Y por otro, ponderar los beneficios, los riesgos, los inconvenientes y los costes de las mismas y decidir si este balance es lo suficientemente favorable como para justificar sus inconvenientes y sus costes.
En una situación de sobrecarga de información1 con dificultades para la toma de decisiones de los clínicos y de variabilidad no justificada, por las circunstancias del paciente o del contexto de dichas decisiones, no es práctico que el médico clínico sea el que realice la valoración global de la evidencia científica para tomar la decisión. Por ello, aparecen las guías de practica clínica (GPC), junto a otros instrumentos como las revisiones sistemáticas de la literatura, protocolos, vías clínicas, etc. que ofrecen una ayuda importante para escoger la decisión más correcta, entendida como la que tiene el mejor balance entre beneficios, inconvenientes y costes, y que a la vez se adapta mejor a las circunstancias del paciente y se pueda por tanto, conseguir los mejores resultados de salud2.
Las GPC tienen características propias que las diferencian de otros instrumentos y que las definen como "directrices elaboradas sistemáticamente para asistir a los clínicos y a los pacientes en la toma de decisiones sobre la atención sanitaria adecuada para problemas clínicos específicos”3. Características como el rigor de su desarrollo, su flexibilidad, o el aportar instrumentos para la implantación de las recomendaciones, han hecho que las guías, en general, y en particular las desarrolladas con la metodologías de la medicina basada en la evidencia, estén viendo incrementado su prestigio y su uso en general por parte de los profesionales y de los sistemas sanitarios. Pero este hecho no está exento de dificultades para el uso adecuado de las GPC:
- En la actualidad existen una gran cantidad de guías, pero a veces con duplicidades e inconsistencias y con gran variabilidad en la calidad de las mismas. En muchas ocasiones las guías publicadas no alcanzan unos criterios mínimos de calidad4,5. En definitiva ¿cómo seleccionar una GPC de calidad?
- Existen demasiados sistemas de clasificación de la evidencia científica que generan confusión y desánimo. La mayor parte de las veces no es demasiado explícito el proceso por el cual un grupo elaborador de guías recomienda o no recomienda una intervención. Factores como el balance entre riesgos y beneficios, datos imprecisos, las preferencias de pacientes, sesgos de publicación y los costes no se consideran explícitamente en los juicios sobre la calidad de la evidencia y las recomendaciones6.
- Por último, incertidumbres, variabilidad y gran dificultad en la difusión y reproducción de las experiencias de adaptación e implementación de las recomendaciones.
Los usuarios de GPC y otras recomendaciones, necesitan saber hasta qué punto pueden confiar en ellas y qué pautas pueden facilitar su incorporación a la práctica clínica. El propósito de este artículo es dar a conocer tres proyectos que han surgido en los últimos años para paliar las dificultades, anteriormente mencionadas, con las que se encuentran los usuarios de guías, mejorando la confianza y facilitando la aplicación de las mismas.
Los instrumentos
1. El AGREE
Junto a la proliferación de GPC, se hacen patentes los problemas de calidad, entendida esta como “la confianza en que se han evitado, en el desarrollo de una guía, los sesgos potenciales y que sus recomendaciones tienen validez interna y externa, y utilidad para la práctica clínica”3. La calidad no es un aspecto banal para los usuarios de las GPC, ya que puede aumentar o disminuir las probabilidades de que se implanten o no las guías y que finalmente se obtengan o no beneficios o daños en los pacientes y en el servicio sanitario4.
La calidad varia según los países y el área de salud en los que se evalúa, la metodología y desarrollo de los estudios, la temática de las guías, o las diferencias en el contexto o la población de los que parten y hacia los que se dirigen las guías. Pero en general se encuentra que la calidad de las GPC es mejorable7,8 y en algunos países como el nuestro no solamente hay guías de baja calidad, sino que se da un bajo grado de aceptación por parte de los profesionales y de inclusión en los programas de calidad de los servicios sanitarios9,10.
Para valorar la calidad de las GPC han ido surgiendo criterios, escalas e instrumentos que permiten discriminar entre ellas de cara a la inclusión en registros o almacenes de guías o para su adopción e implantación en sistemas sanitarios. Se pueden identificar más de veinticuatro instrumentos11,12, pero solo algunos han sido validados, como el de Shaneyfelt et al13 o el de la colaboración AGREE14. A partir del instrumento de Cluzeau et al y tratando de disponer de un único instrumento de uso común, se establece una colaboración entre los principales países (diez países europeos, Estados Unidos, Canadá y Nueva Zelanda) con mayor desarrollo en programas de guías, y se diseña un proyecto multicéntrico, que elabora (1998-2001), valida y publica en 2003 el instrumento AGREE en su versión final14.
Desde entonces el AGREE ha sido adoptado por el Consejo Europeo, la OMS, la Internacional Guidelines Network y por multitud de países, se ha traducido a más de siete idiomas, y se ha convertido en el estándar oro en su campo, demostrando en comparación con otros instrumentos similares11,12 que es un instrumento exhaustivo en cuanto a taxonomía, dimensiones y criterios que utiliza y a la vez equilibrado en cuanto a su facilidad de uso, siendo idóneo para valorar la calidad de una GPC de cara a su utilización, independientemente del tema que aborde o del contexto de que se trate, y para comparar entre sí distintas guías y distintos evaluadores.
Se trata pues de un instrumento “genérico” (cualquier enfermedad o área), desarrollado por un grupo internacional de expertos para evaluar la calidad de todo tipo de GPC (sesgos potenciales en el desarrollo, recomendaciones con validez externa e interna, aplicabilidad en la práctica) evaluando los beneficios, daños, costes y los aspectos prácticos de su aplicación así como la probabilidad de alcanzar los resultados y dirigido a gestores sanitarios, clínicos y educadores en capacidad crítica.
El instrumento consta de 23 criterios agrupados en 6 áreas o dominios (tabla l), que son valorados con una escala tipo Likert de cuatro puntos. Otorgar un 4 significa que el evaluador está completamente de acuerdo en que la guía cumple el criterio, en cambio si se está completamente de acuerdo en que no lo cumple se otorga un punto, y si no se está completamente de acuerdo - dudas - de que se cumple o que no se cumple se otorgan respectivamente 3 o 2 puntos (fig1). Se agregan las puntuaciones de los criterios de cada área y se calcula el porcentaje obtenido respecto del total, asimismo se hace un cálculo estandarizado con las puntuaciones de los distintos evaluadores, a mayor número de evaluadores aumenta la fiabilidad (para una evaluación formal se recomienda un mínimo de 4) y deben tener una mínima familiaridad con el instrumento.
Tabla1. Áreas o dominios del AGREE y nº de criterios por área Mostrar/ocultar
Figura 1. Alcance y objetivo Mostrar/ocultar
Finalmente con la puntuación por áreas, se clasifica la GPC como muy recomendada, recomendada, o no recomendada (tabla2). Se estima en 1,5 horas el tiempo necesario para realizar una evaluación formal. En el instrumento se aportan “pistas” y ejemplos para la correcta interpretación de los criterios, se puede ampliar la información consultando el manual o guía del usuario que complementan al instrumento AGREE; ambos se pueden obtener en español15.
Tabla 2. Valoración Global de la Guía* Mostrar/ocultar
2. El GRADE
Hace tiempo que se introdujo el primer sistema de clasificación de la calidad de la evidencia y la fuerza de las recomendaciones16. Desde entonces numerosas organizaciones e instituciones han ido desarrollando sus propios sistemas y, actualmente, se contabilizan más de cien17. Es indudable que muchos de estos sistemas han contribuido a mejorar el proceso de elaboración de las recomendaciones y a facilitar su interpretación; no obstante, su proliferación y diversidad también ha generado gran confusión y dificultades en la interpretación y aplicación de las mismas18.
Sirva el ejemplo de la tabla 3 donde se observa la diferencia en la clasificación de la evidencia y las recomendaciones que realizan tres prestigiosas organizaciones en el uso de anticoagulación oral en pacientes con fibrilación auricular y enfermedad de la válvula mitral.
Tabla 3. Diferencia en la clasificación de la evidencia y las recomendaciones de tres organizaciones en el uso de anticoagulación oral en pacientes con fibrilación auricular y enfermedad de la válvula mitral Mostrar/ocultar
Además, la formulación de recomendaciones de una GPC conlleva la realización de juicios sobre la calidad de la evidencia, acerca del balance entre beneficios y riesgos, y sobre si es lo suficientemente favorable como para justificar los inconvenientes y los costes. La mayoría de estos juicios se hacen de forma implícita17 o se mezclan los juicios sobre la calidad de la evidencia con los juicios sobre el balance entre beneficios y riesgos. Esto dificulta a los usuarios de las GPC la confianza en la validez y la aplicabilidad de las recomendaciones. Algunos sistemas de clasificación ni siquiera tienen en cuenta el balance entre beneficios y riesgos y asignan la fuerza de recomendación a partir de la calidad de la evidencia exclusivamente: Por ejemplo, es frecuente encontrar una recomendación fuerte sólo por el hecho de estar basada en un ensayo clínico aleatorizado bien diseñado y realizado, sin considerar el balance entre beneficios y riesgos19.
El grupo de trabajo de GRADE comenzó como una colaboración informal entre personas interesadas en abordar las deficiencias de los actuales sistemas de clasificación y tiene como objetivo desarrollar un método común y razonable para clasificar la calidad de la evidencia y la fuerza de las recomendaciones. En el proyecto están implicadas las principales organizaciones e instituciones científicas, además de los principales grupos elaboradores de GPC y otras recomendaciones (ACCP, AHRQ, Australian NMRC, BMJ Clinical Evidence, Cochrane Collaboration, CDC, NICE, Oxford CEBM, SIGN, UpToDate, USPSTF, WHO).
La propuesta del sistema GRADE consiste en17,19:
- Definiciones explícitas de la clasificación de la evidencia y la fuerza de las recomendaciones. La calidad de la evidencia indica hasta que punto podemos confiar en que el estimador del efecto es correcto. La fuerza de las recomendaciones indica hasta que punto podemos confiar en que poner en práctica la recomendación conllevará más beneficios que riesgos (Tabla 4)
Tabla 4. Definiciones explícitas de la clasificación de la evidencia y la fuerza de las recomendaciones Mostrar/ocultar
- Juicios secuenciales explícitos. El sistema clarifica cada uno de estos juicios y reduce el riesgo de introducir errores o sesgos que pueden surgir cuando los juicios se realizan implícitamente.
- Consideración sistemática y explícita en los juicios sobre la calidad de la evidencia sobre diseño del estudio, calidad del estudio, consistencia y si la evidencia es directa o indirecta. Además de tener consideración explícita de los datos imprecisos o escasos, sesgo de factores información, fuerza de la recomendación evidencia sobre el gradiente dosis respuesta y posibles factores de confusión.
- Juicios explícitos sobre qué resultados son claves, importantes pero no claves, poco importantes y que incluso pueden ser ignorados • Consideración explícita del balance entre beneficios y riesgos, la calidad de la evidencia de éstos, la traslación de la evidencia a las circunstancias específicas e incertidumbre del riesgo basal.
- Consideración explícita sobre preferencias de los pacientes y los costes18-20.
En este artículo, no se va a presentar de manera pormenorizada todos los aspectos y la sistemática que los grupos que elaboran GPC necesitan para aplicar este enfoque, sino que intentaremos presentar de forma esquemática el enfoque específico y método de trabajo que propone el sistema. Para hacerlo más comprensible lo iremos exponiendo partiendo del esquema general del proceso de elaboración de una GPC19.
-
Etapa previa:
- 1. Establecer las bases: por ejemplo, priorización de los problemas, selección de un grupo de trabajo para elaborar la guía, declaración de los conflictos de interés y funcionamiento del grupo.
-
Etapa preparatoria:
- 2. Revisión sistemática: el primer paso es identificar, valorar críticamente y preparar las revisiones sistemáticas a partir de la mejor evidencia disponible para todos los resultados importantes.
- 3. Preparar una tabla de síntesis de la evidencia para todos los resultados importantes. Las tablas son necesarias para cada subpoblación o grupo de riesgo, deben estar basadas en los resultados de las revisiones sistemáticas e incluir una evaluación de la calidad y un resumen de las conclusiones.
-
Etapa de clasificación de la calidad de la evidencia y la fuerza de las recomendaciones:Como se puede observar en la tabla 5, GRADE propone ir revisando secuencialmente estos aspectos para cada uno de los resultados que en la etapa anterior se han considerado claves y/o de interés (apartados 4-6).
-
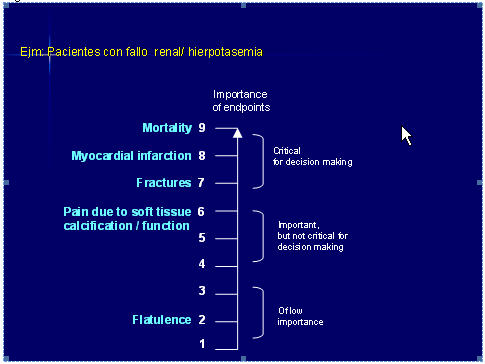
4. La calidad de la evidencia necesita ser considerada para cada uno de los resultados importantes. GRADE propone que como primer paso que el grupo valore por consenso, la importancia relativa de cada resultado en una escala del 1 al 9, para así determinar:
Figura 2. Mostrar/ocultar
- resultados claves para la decisión ( graduación del 7 al 9)
- resultados importantes, pero no claves (graduación del 4 al 6)
- resultado no importantes (graduación del 1 al 3) En la figura 2 presentamos un ejemplo de valoración de los resultados
-
5. Calidad de la evidencia para cada resultado: Segundo paso, la calidad se debe evaluar a partir de la información resumida en la tabla de síntesis de la evidencia de cada uno de los estudios valorados20,21.
Los revisores deberían valorar cuatro aspectos esenciales:- Diseño del estudio: el diseño del estudio se refiere al tipo de estudio.
- Calidad del estudio: la calidad del estudio hace referencia a los métodos utilizados y al rigor en su realización. Los revisores deberían aplicar criterios apropiados para la evaluación de la calidad del estudio para cada resultado importante.
- La consistencia: la consistencia se refiere a la similitud en las estimaciones del efecto entre los estudios. Cuando en los resultados hay una inconsistencia inexplicada e importante, disminuye nuestra confianza en el estimador del efecto para este resultado.
- Si la evidencia es directa o indirecta: la evidencia directa o indirecta indica hasta qué punto los sujetos, las intervenciones y las medidas de resultado de los estudios son similares a aquellos de nuestro interés.
-
4. La calidad de la evidencia necesita ser considerada para cada uno de los resultados importantes. GRADE propone que como primer paso que el grupo valore por consenso, la importancia relativa de cada resultado en una escala del 1 al 9, para así determinar:
Tabla 5. Revisión secuencial de la calidad de la evidencia para cada resultado Mostrar/ocultar
-
6. Calidad global de la evidencia: Tercer paso, la calidad global de la evidencia debería valorarse a partir de los resultados y basarse en la calidad más baja para cualquiera de los resultados clave. Se aplican criterios para otorgar el grado global de evidencia y los aspectos que hacen bajar y subir los grados de calidad, partiendo del tipo de diseño de los estudios valorados19-21. (Tabla 6)
Tabla 6. Tercer paso, la calidad global de la evidencia debería valorarse a partir de los resultados y basarse en la calidad más baja para cualquiera de los resultados clave Mostrar/ocultar
- Así, si estamos valorando la categoría de la evidencia de un efecto a partir de ensayos controlados aleatorizados, estaríamos en principio en la categoría de evidencia fuerte, pero esta puede bajar grados si presenta deficiencias en la calidad, inconsistencias, imprecisión, evidencia indirecta o si sospechan sesgos de publicación. De la misma manera, si partimos de una categoría moderada o baja, por el tipo de diseño que estamos valorando, podríamos subir grados por asociación fuerte, presencia de un gradiente dosis respuesta o presencia de factores de confusión que relucirían el efecto. Todos estos factores son acumulativos. Por ejemplo, si los ensayos aleatorizados presentan limitaciones importantes y también incertidumbre acerca de si la evidencia es directa, el grado de evidencia descendería 2 niveles, del alto al moderado y del moderado al bajo. El interés de este sistema es que te permite hacer los pasos de forma sistemática y hacerlos explícito.
-
Etapa de formulación de recomendaciones22,23:
-
7. ¿Produce la intervención más beneficios que riesgos? Cuarto paso
El balance entre los beneficios en salud y los riesgos debería clasificarse como:- Beneficios netos: la intervención claramente comporta más beneficios que riesgos.
- Beneficios con aceptación de los riesgos: la intervención comporta beneficios y riesgos.
- Beneficios inciertos con aceptación de los riesgos: no está claro que la intervención comporte más beneficios que riesgos.
-
Ausencia de beneficios netos: la intervención claramente no comporta más beneficios que riesgos.
Cuando los beneficios y los riesgos varían en diferentes ámbitos o grupos de pacientes, las recomendaciones se deben adaptar a cada ámbito específico y a cada grupo de pacientes en concreto. Al elaborar recomendaciones, es especialmente importante considerar las particularidades de las poblaciones más desfavorecidas y, si es apropiado, modificar las recomendaciones para tener en cuenta estas desigualdades, para categorizar el balance entre beneficios. En este balance también hay que tener en cuenta los inconvenientes que puede conllevar recomendar una determinada intervención, por ejemplo, si la intervención supone un tratamiento diario, formas de administración, etc.
-
8. Así mismo, hay que tener presente los valores y preferencia de los pacientes. Quinto paso.
Este dato se podrá obtener, si es posible a partir de estudios descriptivos o cualitativos, o bien explorar, si es factible, mediante grupo o foro de pacientes. Una recomendación debería reflejar lo que las personas probablemente escogerían a partir de la evidencia disponible y de sus propios valores o preferencias en relación con los resultados esperados. Una recomendación de «probablemente hazlo» implica que los médicos, al proponer una intervención, consideren los valores y las preferencias de los pacientes de forma más completa y detenida24. -
9. Fuerza de la recomendación: las recomendaciones deberían ser formuladas para que reflejen su fuerza, esto es, hasta qué punto se puede confiar que el poner en práctica esa recomendación será más beneficioso que perjudicial.
Una Recomendación Fuerte a favor de una intervención (en sentido inverso habría que interpretar una recomendación fuerte o débil en contra de una intervención)- La mayoría de Los pacientes se beneficiarán
- >90% lo eligirían si fueran informados
- Poca variabilidad esperada en la práctica clínica
- Incierto que sea lo más adecuado para todos
- 10% eligirían una alternativa ? Es necesaria ayuda para tomar la decisión
- Probable variabilidad en la práctica clínica En resumen para formular la recomendación se tendrá en cuenta cuatro factores: el balance neto entre beneficios y riesgos, la calidad de la evidencia , valores y preferencias y costes(uso de recursos). Figura 3.
Figura 3 Mostrar/ocultar
-
7. ¿Produce la intervención más beneficios que riesgos? Cuarto paso
3. El procedimiento ADAPTE
Hemos visto anteriormente la expansión del desarrollo y uso de las GPC, pese a que se requieren recursos substanciosos en tiempo y costes económicos directos y un equipo de trabajo suficientemente cualificado para desarrollar guías de calidad y mantenerlas actualizadas. Muchos países participan en este fenómeno con guías de calidad variable, a veces con coincidencias en los temas y con concordancia o no de las recomendaciones; esto puede suponer una utilización poco eficiente de recursos y trabajo añadido a la hora de implantar las guías en los servicios sanitarios. Así algunos autores26 sugieren que una alternativa más eficiente sería coordinar los distintos programas de producción de GPC y adaptar e implantar con rigor las guías existentes antes de desarrollar nuevas guías sobre los mismos temas.
A las dificultades para la implantación, se une el hecho de que las decisiones finales adoptadas en el contexto y nivel de que se trate (local, regional o nacional) no solo dependen de la evidencia, sino de intereses, creencias, confianza y motivación personales, con diferencias entre países desde un punto de vista cultural, de población o de organización sanitaria que pueden justificar que haya que hacer modificaciones o incluso desarrollar de nuevo las recomendaciones de una guía desarrollada en un país determinado cuando se va a implantar en otro con diferencias significativas27,28.
Ante estas necesidades surgen experiencias, procedimientos e instrumentos para adaptar las guías desde un nivel a otro en un mismo país (e., desde un contexto nacional a uno regional) o entre distintos países29, como una alternativa eficiente al desarrollo “de novo” y como una oportunidad para incorporar las diferencias culturales y organizativas del contexto local donde se realiza la implantación, aumentando así las posibilidades de lograr el éxito de la implementación y garantizando un producto final (guías o recomendaciones adaptadas al contexto local) de alta calidad. No obstante los procedimientos existentes para esta “adaptación trans-contextual” carecen de rigor en su desarrollo o de validación de su uso30.
Para desarrollar y validar un procedimiento genérico de adaptación que facilite el uso de las guías existentes y aumentar la cooperación entre países y organizaciones evitando duplicidades, surge una colaboración internacional “La Colaboración ADAPTE”, que integra investigadores y personas encargadas del desarrollo o de la implementación de guías. La Guidelines Internacional Network (GIN)31 celebró un taller sobre adaptación de guías dentro de su reunión de 2004 en Nueva Zelanda, con integrantes de la colaboración franco- canadiense para adaptación de guías, el grupo de adaptación de GIN y el grupo de desarrollo de guías de Nueva Zelanda.
Tras la unión de los dos grupos iniciales más importantes, el grupo ADAPTE y el grupo de Evaluación de guías de práctica clínica y de Ciclo de Adaptación (PGEAC: Practice Guideline Evaluation and Adaptation Cycle), comienza a elaborar un marco y un procedimiento para la evaluación y adaptación de la guías32, y se van incorporando a la Colaboración ADAPTE más de 15 miembros de países y organizaciones, como grupos y federaciones de organizaciones contra el cáncer33, escuelas de enfermeras, universidades, agencias y organismos gubernamentales, para trabajar hacia los objetivos mencionados. Se pueden consultar los actuales miembros en la página web de la Colaboración ADAPTE en www.adapte.org.
Esta colaboración internacional define en 2006 la adaptación de guías como “un proceso sistemático para considerar la utilización y o modificación de guías producidas en un contexto cultural y organizativo para su aplicación en otro contexto”. Cuando existe similitud entre el contexto en el que se desarrolla la GPC y el contexto en el que se va a aplicar en cuanto a la población, estructura-proceso de atención y a la no existencia de barreras adicionales a las consideradas en la guía (de recursos, impacto económico, intereses o factibilidad) se habla de “adopción” en vez de adaptación.
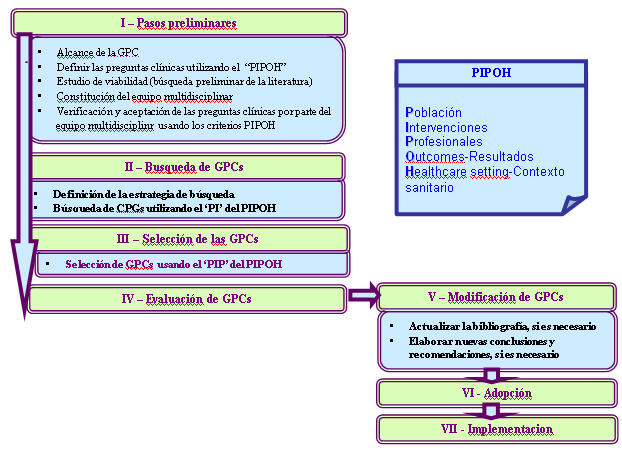
El grupo ADAPTE plantea un marco para la evaluación y adaptación de las guías, un proceso que sigue tres fases (preparación, adaptación, finalización), nueve módulos y 24 pasos, que se ilustran en la Tabla 7 y Figura 4, y que se describen en profundidad en el manual de la colaboración (Adapte Manual for Guideline Adaptation. Version 1.0. 2007, disponible en www.adapte.org) y un conjunto de herramientas para facilitar el recorrido del proceso de adaptación a las personas y grupos que aborden la adaptación e implementación de guías, todos estos instrumentos están disponibles en su página web.
Tabla 7: Fases y módulos del procedimiento ADAPTE Mostrar/ocultar
Figura 4 Mostrar/ocultar
El procedimiento ADAPTE está en fase de validación y refinamiento. Se inició en la reunión del GIN en Toronto34 en 2007 y se prevé que finalice en 2010. Dispone de una aplicación web para registrar la opinión de grupos e investigadores sobre el procedimiento con más de 127 grupos registrados, de más de 30 países; un pilotaje compartido entre los grupos de Francia y Québec y además una serie de grupos que han empezado a recoger y publicar las experiencias de su uso. Las primeras evaluaciones indican que la mayoría de los profesionales lo valoran como un procedimiento suficientemente claro, útil y aplicable.
Entre sus fortalezas se destaca que aunque está aun en fase de validación y evaluación, puede reducir la duplicidad en los esfuerzos de implantación de las recomendaciones, en particular en cuanto a la fase de revisiones sistemáticas para el desarrollo de las recomendaciones, utilizando menos tiempo (10 meses frente a 16-18) y recursos que la elaboración “de novo”, puede ayudar a tener más en cuenta los factores y particularidades locales del contexto desde el desarrollo de las recomendaciones, hasta su implantación final.
Es un procedimiento genérico y por tanto apto para GPC de cualquier enfermedad, distintos formatos (papel o electrónico), y para aspectos de diagnóstico, tratamiento, promoción o cuidados de la salud. Es de carácter sistemático por el rigor en los pasos y dimensiones que abarca (calidad, actualidad y coherencia, aceptabilidad y aplicabilidad del contenido clínico) y transparente por lo que además de producir guías adaptadas de suficiente calidad, validez y utilidad, puede aumentar la confianza e intención de uso de los usuarios de las guías y permitir su participación a través de los grupos multidisciplinares de adaptación.
Como limitaciones está el hecho de que casi un tercio de los profesionales que lo han utilizado valoran que es demasiado complejo para su uso por parte de los clínicos sin formación o asesoramiento específicos, lo que puede limitar su uso, incluso entre los miembros del grupo de adaptación, aunque estas resistencias, altas al principio, suelen desaparecer a medida que se va conociendo el procedimiento.
Otras dificultades surgen de aspectos propios de las GPC como su heterogeneidad en cuanto a la calidad, falta de transparencia o de actualidad que pueden dificultar realizar con éxito la adaptación. Por ejemplo si no se encuentra ninguna guía actualizada35 (se estima un periodo medio de 3 años) se puede impedir tomar la decisión de adaptarla. De igual forma se pueden presentar resistencias en los usuarios de las guías por falta de confianza en el proceso de adaptación.
En resumen, aunque se trata de un procedimiento en fase de validación y mejora en cuanto a su facilidad de uso, las primeras experiencias indican que puede ser útil a nivel local, en la tarea de adaptar e implantar guías de alta calidad que por sus costes y rigor de desarrollo han de ser desarrolladas a nivel nacional o internacional, reduciendo costes y aumentando la confianza y la participación de los usuarios en el proceso de adaptación primero y en la utilización de la guía adaptada una vez desarrollada, garantizando en todo momento la calidad y rigor en el proceso para conseguir mejorar los resultados de salud en el contexto local.
Conclusiones
- Las GPC necesitan mejorar sus métodos, instrumentos y procedimientos para alcanzar los principales retos que tienen planteados en la actualidad, como el desarrollar guías de alta calidad en menos tiempo y con menores costes, el mantenerlas actualizadas en un periodo razonable, e incrementar su uso efectivo para mejorar los resultados en los pacientes y la calidad de los servicios sanitarios.
- Los instrumentos, procedimientos y herramientas para mejorar el desarrollo de las GPC, la valoración de su calidad y su adaptación a diferentes contextos, aquí descritos, tratan de superar las lagunas existentes o las limitaciones de instrumentos previos, a través de una metodología rigurosa y equilibrada con un nivel de complejidad aceptable para su uso por clínicos, metodológos e incluso los pacientes, y contando desde su inicio con una amplia participación de expertos, organizaciones y países que garanticen no solo la calidad y validez de los instrumentos sino su amplia aceptación e impacto internacional.
- Pese a los indudables avances producidos en los últimos quince años en el mundo de las GPC, y a la presencia de los instrumentos y procedimientos descritos, aun quedan áreas a desarrollar, como la mejora de los procedimientos de evaluación de los resultados clínicos producidos por las guías o la selección de las intervenciones y estrategias más efectivas para lograr y mantener los cambios en las organizaciones sanitarias, en los profesionales y en los pacientes, así como aumentar la calidad de las guías que se producen entre los distintos países y la colaboración entre los mismos para su desarrollo y utilización.
Cómo citar este artículo
Guerra de Hoyos JA, Rivas Aguayo D, Ruiz-Canela Cáceres J. Instrumentos para el desarrollo y uso de las guías de práctica clínica basadas en la evidencia. Evid Pediatr. 2008;4:87.
Bibliografía
- Hibble A, Kanka D, Pencheon D, Pooles F. Guidelines in general practice: the new Tower of Babel?. BMJ 1998;317:862-3.
- Martín Muñoz P, Ruiz-Canela J. Guías de práctica clínica (I): conceptos básicos. Evid Pediatr. 2008;4:61.
- Field MJ, Lohr KN, editors. Guidelines for Clinical Practice: from development to use. Washington (DC): Institute of Medicine, National Academy Press;1992
- Woolf SH, Grol R, Hutchinson A et al. Clinical guidelines: potential benefits, limitations, and harms of clinical guidelines. BMJ. 1999;318:527–30.
- Shaneyfelt TM, Mayo-Smith MF, Rothwangl J. Are guidelines following guidelines? The methodological quality of clinical practice guidelines in the peer-reviewed medical literature. JAMA .1999;281:1900–5.
- Guyatt GH, Oxman AD, Vist GE, Kunz R, Falck-Ytter Y, Alonso-Coello P, et al HJ; GRADE Working Group. GRADE An emerging consensus on rating quality of evidence and strength of recommendations. BMJ. 2008;336:924-26.
- Boluyt N, Lincke CR, Offringa M. Quality of evidence-based pediatric guidelines. Pediatrics .2005;115:1378-91.
- de Haas ER, de Vijlder HC, van Reesema WS, van Everdingen JJ, Neumann HA. Quality of clinical practice guidelines in dermatological oncology. J Eur Acad Dermatol Venereol. 2007;21:1193-8.
- Navarro Puerto MA, Ruiz Romero F, Reyes Domínguez A, Gutiérrez Ibarlucea I, Hermosilla Gago T, Alonso Ortiz del Río C et al. Rev Clin Esp.2005;205:533-40.
- Navarro Puerto MA, Ibarluzea IG, Ruiz OG, Alvarez FM, Herreros RG, Pintiado RE, et al. Analysis of the quality of clinical practice guidelines on established ischemic stroke. Int J Technol Assess Health Care. 2008;24:333-41.
- Vlayen J, Aertgeerts B, Hannes K, Sermeus W, Ramaekers D.A systematic review of appraisal tools for clinical practice guidelines: multiple similarities and one common deficit. Int J Qual Health Care 2005;17:235-42.
- Rico Iturrioz R, Gutiérrez-Ibarluzea I, Asua Batarrita J, Navarro Puerto MA, Reyes Domínguez A, Marín León I, et al. Assessment of clinical practice guidelines evaluation. Scales and criteria. Rev Esp Salud Publica 2004;78:457-67.
- Cluzeau FA y Littlejohns P. Appraising clinical guidelines in England and Wales: The development of a methodological framework and its application to policy. Jt Comm J on Qual Improv. 1999;25:514-21.
- The AGREE Collaboration. Development and validation of an international appraisal instrument for assessing the quality of clinical practice guidelines: The AGREE (Appraisal of Guidelines Research and Evaluatión) project. Qual Saf Health Care 2003;12:18-23.
- The AGREE Collaboration. AGREE Instrument Spanish version. [Internet]. Osteba. Departamento de Sanidad del Gobierno Vasco;2001.
- Anonymous: Canadian Task Force on the Periodic Health Examination. The periodic health examination. CMAJ 1979;121:1193-254.
- The GRADE Working Group. Systems for grading the quality of evidence and the strength of recommendations I: critical appraisal of existing approaches. BMC Health Serv Res. 2004;4:38.
- Marzó Castillejo M, Montaño Barrientos A. El sistema GRADE para la toma de decisiones clínicas y la elaboración de recomendaciones y guías de práctica clínica. Aten Primaria. 2007;39:457-61.
- Marzo- Castillejo M, Alonso-Coello P, Rotaeche del Campo R. ¿Cómo clasificar la calidad de la evidencia y la fuerza de las recomendaciones?. Aten Primaria. 2006;37:5-8.
- Alonso-Coello P, Rotaeche del campo R, Etxeberria Agirre A. Sistema GRADE para la evaluación de la calidad de la evidencia y la graduación de las recomendaciones. Guias Clínicas. 2008;8(42).
- Guyatt GH, Oxman AD, Kunz R, Vist GE, Falck-Ytter Y, Schünemann HJ; GRADE Working Group. GRADE Working Group. What is "quality of evidence" and why is it important to clinicians?. BMJ. 2008;336:995-8.
- Guyatt GH, Oxman AD, Kunz R, Falck-Ytter Y, Vist GE, Liberati A, et al; GRADE Working Group. Going from evidence to recommendations. BMJ. 2008;336:1049-51.
- Guyatt GH, Oxman AD, Vist GE, Kunz R, Falck-Ytter Y, Alonso-Coello P, et al; GRADE Working Group. GRADE: an emerging consensus on rating quality of evidence and strength of recommendations. BMJ. 2008;336:924-6.
- Guyatt GH, Oxman AD, Kunz R, Jaeschke R, Helfand M, Liberati A, et al; GRADE Working Group. Incorporating considerations of resources use into grading recommendations. BMJ. 2008;336:1170-3.
- Baker R, Feder G. Clinical guidelines: where next?. In J Qual Health Care. 1997;9:399–404.
- World Health Organization. Global Programme on Evidence for Health Policy. Guidelines for WHO Guidelines. EIP/GPE/EQC/2003.1. Geneva,World Health Organization;2003.
- Eisinger F, Geller G, Burke W, Holtzman NA. Cultural basis for differences between US and French clinical recommendations for women at increased risk of breast and ovarian cancer. Lancet. 1999;353:919–20.
- Manna DR, Bruijnzeels MA, Mokkink HG, Berg M. Ethnic specific recommendations in clinical practice guidelines: a first exploratory comparison between guidelines from the USA, Canada, the UK, and the Netherlands. Qual Saf Health Care. 2003;12:353–8.
- Fervers B, Burgers JS, Haugh MC, Latreille J, Mlika-Cabanne N, Paquet L, et al. Adaptation of clinical guidelines: literature review and proposition for a framework and procedure. Int J Qual Health Care. 2006;18:167-76.
- Schünemann HJ, Fretheim A, Oxman AD. Improving the use of research evidence in guideline development: 13. Applicability, transferability and adaptation. Health Res Policy Syst. 2006;4:25.
- Ollenschläger G, Marshall C, Qureshi S, Rosenbrand K, Burgers J, Mäkelä M, et al; Board of Trustees 2002, Guidelines International Network (G-I-N). Improving the quality of health care: using international collaboration to inform guideline programmes by founding the Guidelines International Network (G-I-N). Qual Saf Health Care. 2004;13:455-60.
- Fervers B, Burgers JS, Haugh MC, Latreille J, Mlika-Cabanne N, Paquet L, et al. Adaptation of clinical guidelines: literature review and proposition for a framework and procedure. Int J Qual Health Care. 2006;18:167-76.
- Philip T, Fervers B, Haugh M, Otter R, Browman G. European cooperation for clinical practice guidelines in cancer. Br J Cancer. 2003;89 Suppl 1:S1-3.
- Guideline Internacional Network. 4TH International G-I-N Conference, Toronto, 2007.
- Shekelle PG, Ortiz E, Rhodes S, Morton SC, Eccles MP, Grimshaw JM, et al. Validity of the Agency for Healthcare Research and Quality clinical practice guidelines: how quickly do guidelines become outdated?. JAMA. 2001;286:1461-7.




Envío de comentarios a los autores