Toma de decisiones clínicas basadas en pruebas científicas
EVIDENCIAS EN PEDIATRÍA
Septiembre 2022. Volumen 18. Número 3
| Tratamiento corto frente a largo en la neumonía adquirida en la comunidad
Valoración: 0 (0 Votos)Autores: Ochoa Sangrador C, Ortega Páez E.
 Suscripción gratuita al boletín de novedades
Suscripción gratuita al boletín de novedades
Reciba periódicamente por correo electrónico los últimos artículos publicados
Suscribirse |
Autores:
Correspondencia:
Escenario Clínico
Niño de 4 años, sin antecedentes familiares ni personales de interés, que consulta por cuadro de tos de cuatro días de evolución, fiebre en las últimas 36 horas, con pico máximo de 38,5 °C. El paciente presenta buen estado general y un triángulo de evaluación pediátrica estable. A la auscultación aprecias hipoventilación leve basal derecha con crepitantes basales y una frecuencia respiratoria de 35 por minuto. Estableces un diagnóstico de neumonía adquirida en la comunidad y decides iniciar tratamiento antibiótico oral ambulatorio con amoxicilina, pero a la hora de hacer la prescripción te surgen dudas sobre la duración del tratamiento.
Consultando el protocolo del Grupo de Vías Respiratorias de la Asociación Española de Pediatría de Atención Primaria, actualizado a 2020, ves que recomiendan tratamiento con amoxicilina durante 5-7 días1. El protocolo de consenso de las Sociedades de Infectología y Neumología Pediátrica y del Comité Asesor de Vacunas de las Asociación Española de Pediatría2, de 2015, proponía una pauta de 7 días y la guía NICE3, de 2019, indicaba 5 días. Una revisión sistemática de guías de práctica clínica reciente mostraba heterogeneidad entre guías con duraciones entre 3 y 10 días4. Por ello te planteas hacer una búsqueda bibliográfica y valorar la evidencia.
Pregunta estructurada: PICO o PIO
¿En la población pediátrica con diagnóstico de neumonía adquirida en la comunidad no grave, una pauta de antibioterapia oral con amoxicilina inferior o igual a 5 días en comparación con una de 7 o más días es menos eficaz?
Búsqueda y evaluación de la evidencia
Fecha de formulación: 1 de septiembre de 2022.
Para esta revisión buscamos ensayos clínicos que hayan comparado la eficacia clínica de pautas de tratamiento con amoxicilina de corta (≤5 días) y larga duración (≥7 días), en pacientes ambulatorios.
Realizamos una búsqueda por dos revisores independientes en las siguientes bases de datos: Pubmed, Embase y Cochrane Register of Controlled Trials (CENTRAL).
En Pubmed los términos de búsqueda fueron: ((("Pneumonia"[Mesh] OR Pneumon* OR "lower respiratory infection" OR “lower respiratory tract infection” OR “LRTI”) AND "Community-Acquired Infections"[Mesh]) OR “Community-acquired pneumonia” OR “CAP” OR “non-severe pneumonia”) AND (clinicaltrial[Filter] OR meta-analysis[Filter] OR systematicreview[Filter]) AND ("duration of therapy"[MeSH] OR ("duration"[All Fields] AND "therapy"[All Fields]) OR “Drug Administration Schedule”[Mesh] OR "Anti-Infective Agents/administration and dosage"[Mesh] OR “Short course”[All Fields] OR "duration of therapy"[All Fields] OR (“Short”[All Fields] AND ("therapy"[All Fields] OR "treatment"[All Fields]))) AND (allchild[Filter]). En otras bases de datos se emplearon estrategias adaptadas de esta.
Dos autores examinaron títulos y resúmenes y consensuaron la selección de artículos. Los artículos seleccionados fueron examinados a texto completo.
Elaboramos tablas resumen de evidencia con los datos extraídos de los trabajos revisados (tabla 1). Evaluamos la calidad de la evidencia siguiendo la metodología GRADE, valorando el riesgo de sesgos de los ECA con la herramienta RoB-2 (Risk of Bias) de la Colaboración Cochrane.
Tabla 1. Descripción de los estudios incluidos en esta revisión. Mostrar/ocultar
Consideramos medida principal el fallo de tratamiento, entendiendo como tal la necesidad de tratamiento de rescate o ingreso hospitalario. Como medidas secundarias se consideraron el cumplimiento terapéutico, los efectos adversos, la colonización nasofaríngea por neumococos y el riesgo de desarrollo de resistencias bacterianas.
Para la medida principal de efecto estimamos la reducción absoluta del riesgo ponderada y sus intervalos de confianza, con datos por intención de tratar, usando modelos de efectos aleatorios con RevMan 5.4. La heterogeneidad se estimó calculando el I2. Se planificó explorar sesgos de publicación si se disponía de 5 o más estudios.
Resultados
Se encontraron 202 referencias, excluidos duplicados. Dos autores examinaron títulos y resúmenes, seleccionando por consenso once artículos que fueron revisados a texto completo. Cuatro estudios cumplieron los criterios de inclusión5-8. Se identificaron 3 revisiones sistemáticas desactualizadas que no incluían estos estudios9-11. Se descartaron tres ensayos12-14 realizados en países en vías de desarrollo, que comparaban pautas de 3 y 5 días, incluidos en la revisión de Sutijono et al.11. En la tabla 1 se presentan las características de los ensayos seleccionados.
Tres de los estudios solo incluían pacientes ambulatorios no graves5,7,8, mientras que el cuarto6 aleatorizaba también un 30% de pacientes que previamente habían estado ingresados con tratamiento antibiótico, aunque facilitaban datos diferenciados de dichos pacientes. La mayoría de los pacientes eran menores de 5 años y recibieron dosis altas de amoxicilina (80-100 mg/kg/día), salvo en un estudio6 con un diseño factorial que comparaba duraciones corta-larga y dosis bajas-altas. En uno de los trabajos8 el 91% recibió amoxicilina a dosis altas, mientras que el resto recibió amoxicilina-clavulánico o cefnidir. Solo uno de los estudios exigía confirmación radiológica de los diagnósticos5.
En todos los estudios la pauta larga fue de 10 días. Greenberg et al.5 la compararon en una primera fase con una pauta de 3 días, con la que se encontraron muchos fracasos de tratamiento, por lo que se empleó en una segunda fase una pauta de 5 días. El estudio factorial de Bielicki6 utilizó la pauta corta de 3 días y los otros dos, de 5 días.
En la tabla 2 se presenta la evaluación de riesgo de sesgos de los estudios. Aunque los trabajos están descritos como doble ciego, el enmascaramiento para pacientes-familiares ofrece alguna duda, aunque en todos se enmascaró la evaluación de resultados. El estudio de Greenberg et al.5 presentó un alto porcentaje de pérdidas y un cambio de protocolo, mientras que en el de Bielicki et al.6 la medida fallo de tratamiento no incluía el ingreso. No se pudo evaluar el sesgo de publicación.
Tabla 2. Valoración de sesgos de ensayos clínicos aleatorizado (RoB). Mostrar/ocultar
Hubo diferencias en los criterios empleados como fallo de tratamiento, que en su mayoría incluían la necesidad de tratamiento de rescate u hospitalización por encima de los 14 días. Williams et al.8 eligieron como medida principal de efecto una escala que incluye la necesidad de consulta o ingreso y la persistencia de síntomas y efectos adversos, aunque ofrece datos que permiten estimar el fallo de tratamiento. Solo el estudio de Williams et al.8 se planteó como análisis de superioridad; los otros planteaban un análisis de no inferioridad con umbrales de diferencia clínicamente importante entre 7,5 y 10%.
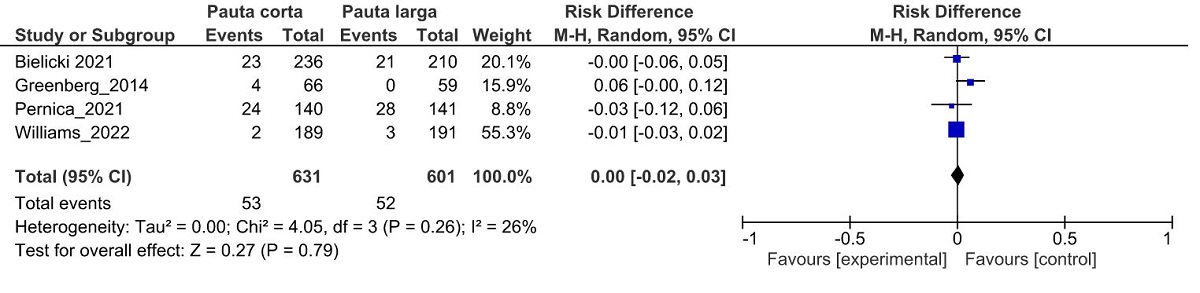
En la figura 1 se presenta el metanálisis del fallo de tratamiento. El riesgo de fracaso fue similar con tratamiento corto (8,3%) y largo (8,6%), que corresponde a una reducción absoluta del riesgo de -0% (intervalo de confianza del 95% de -2 a 3%). La interpretación de este resultado sugiere equivalencia entre los tratamientos corto y largo, dado que el intervalo de confianza se encuentra comprendido entre márgenes de no inferioridad y no superioridad más estrictos que los planteados por los investigadores, como podría ser un 5%.
Figura 1. Metanálisis de fallo de tratamiento a más de 14 días,comparando tratamiento corto (≤5 días) vs. largo (≥7 días). Mostrar/ocultar
En la tabla 3 se presenta la valoración GRADE de la evidencia. La medida de efecto es importante (no crítica), pero la calidad de la evidencia es moderada por la existencia de algún riesgo de sesgo.
Tabla 3. Valoración Grade de la duración del tratamiento ambulatorio de la neumonía adquirida en la comunidad. Mostrar/ocultar
No se observaron diferencias en efectos adversos ni en cumplimiento. Solo uno de los trabajos evaluó el efecto sobre el estado de portador de neumococo a los 28 días, sin diferencias entre grupos6. Otro estudio midió a los 19-25 días el riesgo de desarrollo de resistencias, encontrando más genes de resistencia con el tratamiento largo (medianas de 1,17 y 1,33 genes), aunque no está clara la importancia clínica de esta diferencia.
Comentario
La evidencia disponible sugiere que un tratamiento antibiótico con amoxicilina para NAC no graves de al menos 5 días es equivalente al de 7 o más días. Los resultados parecen aplicables a nuestro medio, dado que, aunque pueden existir diferencias en la prevalencia de portadores de neumococo y en la sensibilidad antibiótica de estos, su influencia sobre la eficacia debería ser baja, especialmente si se usan dosis altas de amoxicilina.
Es preciso advertir que cualquier estudio realizado sobre el tratamiento antibiótico en infecciones respiratorias no graves en la infancia va a tender a no mostrar diferencias. El predominio de las infecciones de etiología vírica, incluso con NAC de patrón radiológico típico, y la tendencia a la resolución de algunas infecciones bacterianas implicadas, va a abocar a que tanto si se comparan pautas largas y cortas como dosis altas y bajas no encontremos diferencias.
Aunque es esperable que pautas más cortas mejoren el cumplimiento y reduzcan los costes y los efectos adversos de los tratamientos, en los trabajos analizados no hay evidencia al respecto. Es posible que sean necesarios estudios observacionales más amplios para explorar estas medidas de efecto. También es previsible que la menor duración de los tratamientos pueda minimizar el desarrollo de resistencias, aunque la evidencia encontrada, procedente de un solo estudio, es imprecisa y de dudosa significación clínica.
Resolución del escenario
En nuestro paciente se decide recomendar 5 días de tratamiento, con contacto telefónico a los 5 días, para evaluar la evolución y replantear la duración de tratamiento. Informamos a los padres de que el diagnóstico de NAC es el más probable y que el riesgo de fracaso del tratamiento es bajo (aproximadamente un 8%). No obstante, si en los primeros días de tratamiento no hay mejoría deberíamos reevaluar al paciente; ese sería el momento de revisar el diagnóstico, plantear la necesidad de pruebas complementarias (por ejemplo, una prueba de imagen) y decidir si necesita otra pauta terapéutica.
Bibliografía
- Úbeda Sansano I, Croche Santander B, Hernández Merino A. Neumonía (v.3.0/2020). En: Guía-ABE. Infecciones en Pediatría. Guía rápida para la selección del tratamiento antimicrobiano empírico [en línea] [actualizado el 27/04/2020; consultado el 09/09/2022]. Disponible en www.guia-abe.es/temas-clinicos-neumonia
- Moreno-Pérez D, Andrés Martín A, Tagarro García A, Escribano Montaner A, Figuerola Mulet J, García García JJ, et al. Neumonía adquirida en la comunidad: tratamiento ambulatorio y prevención. An Pediatr (Barc). 2015; 83(6): 439.e1-7.
- Pneumonia (community-acquired): antimicrobial prescribing. En: NICE guideline [en línea] [actualizado el 16/09/2020; consultado el 09/09/2022]. Disponible en www.nice.org.uk/guidance/ng138
- Chee E, Huang K, Haggie S, Britton PN. Systematic review of clinical practice guidelines on the management of community acquired pneumonia in children. Paediatr Respir Rev. 2022; 42:59-68.
- Greenberg D, Givon-Lavi N, Sadaka Y, Ben-Shimol S, Bar-Ziv J, Dagan R. Short-course antibiotic treatment for community-acquired alveolar pneumonia in ambulatory children: a double-blind, randomized, placebo-controlled trial. Pediatr Infect Dis J. 2014; 33:136-42.
- Bielicki JA, Stöhr W, Barratt S, Dunn D, Naufal N, Roland D, et al. Effect of Amoxicillin Dose and Treatment Duration on the Need for Antibiotic Re-treatment in Children With Community-Acquired Pneumonia: The CAP-IT Randomized Clinical Trial. JAMA. 2021; 326:1713-24.
- Pernica JM, Harman S, Kam AJ, Carciumaru R, Vanniyasingam T, Crawford T, et al. Short-Course Antimicrobial Therapy for Pediatric Community-Acquired Pneumonia: The SAFER Randomized Clinical Trial. JAMA Pediatr. 2021; 175:475-82.
- Williams DJ, Creech CB, Walter EB, Martin JM, Gerber JS, Newland JG, et al. Short- vs Standard-Course Outpatient Antibiotic Therapy for Community-Acquired Pneumonia in Children: The SCOUT-CAP Randomized Clinical Trial. JAMA Pediatr. 2022; 176:253-61.
- Haider BA, Lassi ZS, Bhutta ZA. Short-course versus long-course antibiotic therapy for non-severe community-acquired pneumonia in children aged 2 months to 59 months. Cochrane Database Syst Rev. 2008;CD005976.
- Lassi ZS, Das JK, Haider SW, Salam RA, Qazi SA, Bhutta ZA. Systematic review on antibiotic therapy for pneumonia in children between 2 and 59 months of age. Arch Dis Child. 2014; 99:687-93.
- Sutijono D, Hom J, Zehtabchi S. Efficacy of 3-day versus 5-day antibiotic therapy for clinically diagnosed nonsevere pneumonia in children from developing countries. Eur J Emerg Med. 2011; 18:244-50.
- Pakistan Multicentre Amoxycillin Short Course Therapy (MASCOT) pneumonia study group. Clinical efficacy of 3 days versus 5 days of oral amoxicillin for treatment of childhood pneumonia: a multicentre double-blind trial. Lancet. 2002; 360(9336):835-41.
- Agarwal G, Awasthi S, Kabra SK, Kaul A, Singhi S, Walter SD; ISCAP Study Group. Three day versus five day treatment with amoxicillin for non-severe pneumonia in young children: a multicentre randomised controlled trial. BMJ. 2004; 328:791.
- Awasthi S, Agarwal G, Singh JV, Kabra SK, Pillai RM, Singhi S, et al. Effectiveness of 3-day amoxycillin vs. 5-day co-trimoxazole in the treatment of non-severe pneumonia in children aged 2-59 months of age: a multi-centric open labeled trial. J Trop Pediatr. 2008; 54:382-9.
Cómo citar este artículo
Ochoa Sangrador C, Ortega Páez E. Tratamiento corto frente a largo en la neumonía adquirida en la comunidad. Evid Pediatr. 2022;18:30.


Envío de comentarios a los autores