Toma de decisiones clínicas basadas en pruebas científicas
EVIDENCIAS EN PEDIATRÍA
Diciembre 2006. Volumen 2. Número 4
| Evaluación de artículos científicos sobre intervenciones terapéuticas
Valoración: 0 (0 Votos)Autores: González de Dios J, González Rodríguez MP.
 Suscripción gratuita al boletín de novedades
Suscripción gratuita al boletín de novedades
Reciba periódicamente por correo electrónico los últimos artículos publicados
Suscribirse |
Autores:
Correspondencia:
El ensayo clínico: patrón oro en el diseño de intervenciones terapéuticas
El ensayo clínico (EC) es un estudio experimental y prospectivo en el cual el investigador provoca y controla las variables y los pacientes son asignados de forma aleatoria a los distintos tratamientos que se comparan. Dado que es el tipo de estudio epidemiológico que presenta menores errores sistemáticos o sesgos, el EC constituye la mejor prueba científica para apoyar la eficacia de las intervenciones terapéuticas, ya directamente por la información proporcionada por un EC, o indirectamente a través de las revisiones sistemáticas y/o metanálisis de distintos EC.
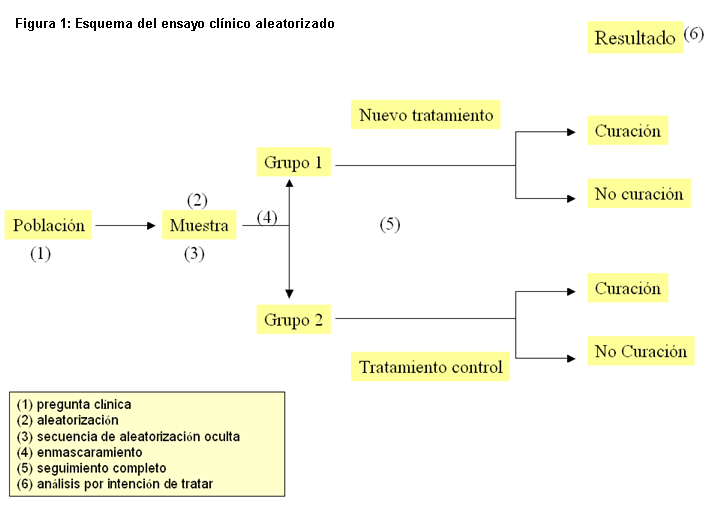
Los EC aleatorizados y controlados permiten evaluar los beneficios de los tratamientos o programas de intervención, ponderando sus riesgos y efectos indeseables. Con ellos podemos controlar los sesgos existentes en otros tipos de estudio y obtener información sólida sobre la relación causal entre una exposición (intervención) y un efecto (inferencia causal). Los EC tienen importantes ventajas: son los estudios que aportan mayor control sobre los distintos factores implicados en el diseño, por lo que son repetibles y comparables; a menudo ofrecen el único diseño posible para contestar a determinadas preguntas de investigación; además, proporcionan la mejor evidencia sobre inferencia causal y generalización de los resultados. Como contrapunto presentan diversos inconvenientes: son estudios costosos en tiempo y dinero, pueden verse limitados por problemas éticos o de factibilidad y en ocasiones la aplicación de sus resultados se ve cuestionada porque la muestra de estudio no representa a la población donde quieren aplicarse1-3. En la figura 1 se indican los pasos fundamentales en su planteamiento.
Figura 1. Esquema del ensayo clínico controlado aleatorizado Mostrar/ocultar
1. Definir una pregunta clínica estructurada: plantear una hipótesis de estudio, que debe ser buena, relevante y ética; se debe realizar una prueba de hipótesis a priori en la que se plantee una hipótesis nula y una hipótesis alternativa. En general el EC debe estar encaminado a contestar una sola pregunta (variable principal de valoración -end point-), que tenga interés desde el punto de vista clínico y en el que se incluyen los tres componentes principales de una pregunta clínica estructurada, bajo el acrónimo PIO (pacientes-intervención-outcomes o variables de resultado). Los estudios que pretenden dar respuesta a varias preguntas suelen ser excesivamente complicados y responden habitualmente de forma parcial a todas ellas.
2. Comparabilidad de los grupos de tratamiento: la aleatorización se define como el procedimiento sistemático y reproducible por el que los sujetos participantes en un EC son distribuidos al azar en los distintos grupos de tratamiento, por lo que disminuye la probabilidad de incurrir en un sesgo de selección y así, la única causa que pudiera justificar las diferencias encontradas, si existe, sería el tratamiento recibido. Las características que debe cumplir un buen método de aleatorización son: la asignación a los grupos de tratamiento debe ser desconocida e imprevisible; el proceso de asignación debe ser reproducible y estar documentado; debe basarse en propiedades matemáticas conocidas; no debe permitir que se prevenga la consecuencia de los tratamientos; los fallos en la asignación de tratamientos pueden ser detectados. Lo ideal es disponer de una secuencia oculta de aleatorización con una comunicación indirecta o a distancia entre el investigador y la secuencia de aleatorización
3. Medición objetiva de los resultados: así como la aleatorización es imprescindible en un EC controlado, el enmascaramiento puede ser obligado (principalmente en caso de valoraciones subjetivas), sólo deseable o, incluso, inaceptable desde el punto de vista ético (si sometemos al paciente a algún tipo de riesgo). El enmascaramiento o carácter ciego de un EC consiste en toda una serie de precauciones o medidas que se toman con el fin de que, a lo largo del estudio, bien el paciente, el médico o ambos, desconozcan la asignación de los tratamientos. El objetivo perseguido al enmascarar los tratamientos utilizados es evitar los sesgos de valoración por parte de todos los implicados en el EC, pero principalmente en el paciente (efecto placebo, efecto nocivo, sesgo de retirada) y el investigador (sesgo de evaluación, sesgo de retirada). Los tipos de enmascaramiento son: simple ciego (el sujeto desconoce el grupo de tratamiento al que pertenece, aunque es a veces el investigador quien desconoce la asignación aleatoria de tratamientos), doble ciego (sujeto e investigador desconocen el tratamiento administrado), triple ciego (también el monitor del EC) y cuádruple ciego (también el análisis estadístico se realiza sin revelar los códigos de los tratamientos); pero se debe tener en cuenta que tratar de conseguir un enmascaramiento perfecto nunca debe suponer un aumento de riesgo para los sujetos.
4. Seguimiento completo: lo que implica considerar las pérdidas (pre y postaleatorización). Las pérdidas prealeatorización, es decir la de los sujetos elegibles producidas antes de su inclusión en el EC (por la negativa de los pacientes a entrar en el estudio o por ser considerados no elegibles de acuerdo a los criterios de inclusión/exclusión), condicionan fundamentalmente la capacidad de generalización de los resultados. Como norma se considera que si un estudio incluye entre el 80 y el 90% de los sujetos elegibles es representativo de la población estudiada. Las pérdidas postaleatorización (abandonos -drop out- y retiradas -withdrawal- de paciente durante el estudio) tienen un significado diferente. En principio las retiradas o abandonos no deben suponer más del 20% de los sujetos puesto que podrían alterar la certeza de los resultados, y en todo caso deben estar previstos cuando se calcula el número de pacientes necesarios para demostrar la hipótesis de trabajo. Lo correcto es reemplazarles, elaborando una lista de aleatorización que contemple estas posibles pérdidas. En cualquier caso es aconsejable realizar el seguimiento de todos los sujetos hasta finalizar el EC.
5.-Análisis de los datos: debe tenerse en cuenta que hay tres áreas del EC en donde se deberá contar con la asesoría de un bioestadístico: en la elección del método de aleatorización, la predeterminación del tamaño de la muestra y el cálculo estadístico de los datos. El no tener, desde el principio, unas ideas claramente definidas de cómo abordar correctamente estas tres áreas, puede convertir los resultados y conclusiones derivadas de él en errores sobre la interpretación del efecto terapéutico.
En el correcto análisis estadístico debe tenerse en cuenta el tamaño muestral, la significación estadística (cuanto mayor sea la p, más fuerte será la evidencia en favor de la hipótesis nula) y la precisión (cuanto menor sea el intervalo de confianza [IC], mayor es la precisión estadística). Es preciso indicar cuáles son las pruebas estadísticas utilizadas para el análisis de los resultados, si éstos son las previstas inicialmente, y si se han obtenido los valores que permitan concluir diferencias estadísticamente significativas para una o dos colas o mediante IC. Especial mención merece el concepto de análisis por intención de tratar (intention to treat): incluye a todos los sujetos que han sido aleatorizados a los grupos de tratamiento, independientemente de que hayan recibido o no alguna dosis del tratamiento asignado o se haya producido algún error en la administración; es por intención de tratamiento, no por tratamiento administrado.
El análisis por intención de tratar tiene dos ventajas fundamentales: 1) es la única estrategia que conserva las ventajas que se adquieren mediante la asignación aleatoria de los participantes; y 2) se aproxima a la realidad de la práctica clínica diaria: en un EC controlado las condiciones de administración de un tratamiento son demasiado rigurosas y los controles de seguimiento muy estrictos, lo que resulta algo artificial en la práctica diaria, donde muchos pacientes no cumplen de manera íntegra el tratamiento o lo rechazan. El análisis por tratamiento, al excluir a los pacientes perdidos, no preserva las ventajas de la aleatorización e implica una disminución de la potencia del estudio. Una manera de intentar resolver las pérdidas en un EC es la estrategia de análisis del peor de los casos: consiste en suponer que todos los pacientes perdidos del grupo donde la mayor parte de los miembros han registrado un resultado favorable han presentado un resultado desfavorable, y todos los pacientes del grupo donde la mayor parte de sus miembros han obtenido un resultado desfavorable evolucionan de forma favorable. Tras hacer esta suposición se vuelven a calcular los resultados del estudio; si tras realizar dicho supuesto, los resultados no varían podemos concluir que las pérdidas no han sido lo suficientemente numerosas como para introducir un sesgo que invalide los resultados de la investigación (si las pérdidas son > 20% es difícil que los resultados superen la estrategia de análisis del peor de los casos).
La descripción deficiente del diseño estadístico del EC es uno de los errores más habituales. No se suele especificar por qué se ha elegido un número determinado de sujetos, ni las razones para elegir un tipo de diseño (en paralelo o cruzado) o aleatorización (en bloques o estratificación) o las diferencias estadísticas que se consideran relevantes desde el punto de vista clínico.
Para calcular a priori el número de sujetos que se necesitan para demostrar con una probabilidad determinada que existen o no diferencias estadísticamente significativas entre los grupos de tratamiento se deben considerar una serie de factores: la probabilidad de un resultado positivo o error alfa (arbitrariamente inferior al 5%), la probabilidad de un resultado negativo o error beta (generalmente inferior al 20%), la diferencia clínicamente significativa que se espera encontrar y las posibles pérdidas después de la aleatorización a lo largo del estudio. No hay que olvidar que con una muestra pequeña resulta difícil detectar diferencias reales, mientras que con una muestra suficientemente grande se puede detectar casi cualquier diferencia por pequeña que sea. Durante los últimos años se insiste en que resulta preferible expresar los resultados en forma de IC que como valor de p, ya que dichos intervalos permiten obtener una idea más real de la magnitud de las diferencias observadas. En la tabla 1 se presenta un ejemplo hipotético respecto al cálculo de las medidas del efecto de una intervención terapéutica.
Tabla 1. Sesgos potenciales en el ensayo clínico Mostrar/ocultar
Se ha de tener en cuenta que en ocasiones se deben realizar análisis intermedios de los datos, ya que por motivos éticos puede evitarse la prolongación innecesaria del EC; por lo tanto se debe establecer una regla de interrupción, consistente en fijar la variable a analizar, así como el número y momento de realización de los análisis estadísticos intermedios que se llevarán a cabo a lo largo del estudio. Los análisis intermedios deben ser ciegos para el investigador, con el propósito de evitar futuros sesgos en el caso de que el EC prosiga; el investigador sólo debe conocer el resultado del análisis si se decide interrumpir el estudio.
6. Recogida de acontecimientos adversos: aunque no condiciona la credibilidad de los resultados y/o generalización de los mismos, es importante puesto que su conocimiento permite valorar la relación riesgo/beneficio del fármaco en estudio y su posición frente a otras alternativas disponibles. Debería indicarse también el método utilizado para su detección (notificación espontánea o pregunta orientada) y el algoritmo seguido para establecer la relación de causalidad.
7. Aspectos éticos: las normas de Buena Práctica Clínica (Good Clinical Practice) consideran estos aspectos éticos, en base a cuatro principios básicos ya enunciados en el informe Belmont en 1978, principalmente los de no maleficencia y autonomía.
8. Extraer conclusiones: interpretación correcta de los resultados, en el que lo importante es valorar la relevancia clínica de las diferencias estadísticamente significativas.
Evaluación de una intervención terapéutica
Siguiendo las recomendaciones del Evidence-Based Medicine Working Group4,5 analizaremos los tres pasos a seguir para analizar la VALIDEZ, la IMPORTANCIA y la APLICABILIDAD (Tabla 3) de los artículos sobre intervenciones terapéuticas, planteando diversas cuestiones3,6,7.
- ¿Son validos los resultados?
- ¿Cuáles son los resultados?
- ¿Son aplicables en tu medio?
Tabla 3. Criterios para la valoración de un artículo sobre tratamiento Mostrar/ocultar
1. ¿Son válidos los resultados del estudio?
Se debe responder a la siguiente cuestión: ¿corresponden los resultados del estudio a una estimación no sesgada del efecto del tratamiento, o se han visto influidos de forma sistemática para conducir a una conclusión falsa?. Y para ello cabe contestar a una serie de preguntas, clasificadas en:
- Criterios primarios: la pregunta debe estar claramente definida y centrada en el problema de interés. Es imprescindible la aleatorización en la asignación de los tratamientos a los pacientes (de forma ideal, con una secuencia oculta de aleatorización). Realización de un seguimiento completo de los pacientes (considerando las pérdidas pre y postaleatorización, en las que el lector tendrá que juzgar en cada caso si las pérdidas serán cualitativa o cuantitativamente importantes como para invalidar los resultados) y el análisis por intención de tratar (que incluye a todos los sujetos que han sido aleatorizados a los grupos de tratamiento, independientemente de que hayan recibido o no alguna dosis de tratamiento asignado o se haya producido algún error en la administración; es por intención de tratamiento, no por tratamiento administrado; su importancia reside en que nos da una idea de lo que sucederá en la practica clínica habitual por comparación con lo que ocurre en las condiciones de un EC, que es lo que determina el análisis por tratamiento o por casos válidos o por protocolo).
- Criterios secundarios: incluyen el enmascaramiento (diseño ciego respecto al tratamiento aplicado, en cuanto a los pacientes, los clínicos y el personal del estudio), la similitud de los grupos al inicio del EC (generalmente se aporta esta información en la tabla 1 de un EC al presentar las características pronosticas iniciales o basales de los grupos de tratamiento y de control; la aleatorización no siempre produce grupos bien equilibrados en cuanto a los factores pronósticos conocidos, y si la magnitud de estas diferencias es grande puede comprometer la validez del estudio) así como la similitud de cointervenciones ( pues las intervenciones distintas del tratamiento en estudio, cuando se aplican de manera distinta a los grupos de tratamiento y de control pueden constituir un problema, y más cuando no se utiliza un diseño a doble ciego o cuando se autoriza el uso de tratamientos muy eficaces, que no son los investigados).
La valoración secuencial de estos criterios (previamente estudiados en el primer apartado de este artículo) nos permitirá juzgar si el estudio es válido y, por lo tanto, si merece la pena seguir adelante examinando la importancia de los resultados y su aplicabilidad.
2. ¿Cuáles son los resultados del estudio?
Si los resultados son válidos el siguiente paso es realizar un análisis detallado de los resultados: aquí se considera la magnitud y la precisión del efecto del tratamiento8
La fuerza de la asociación es la principal medida que indica la validez de una evidencia y existen dos conceptos según el tipo de estudio: el riesgo relativo (RR), que es la medida epidemiológica que se utiliza principalmente en el EC y el estudio de cohortes, y la odds ratio (OR), que se utiliza principalmente en el estudio de casos y controles y en el metanálisis.
El RR es el cociente entre el riesgo de sufrir un determinado evento en el grupo expuesto a un determinado tratamiento o factor de riesgo y el riesgo de sufrir el mismo evento en el grupo control (no expuesto al tratamiento o factor de riesgo). La OR es el cociente entre la odds (razón entre la probabilidad de que un evento suceda y la probabilidad de que no suceda) de exposición observado en el grupo tratado (o expuesto) y la odds de exposición en el grupo de controles (o no expuesto).
¿Cómo interpretar el RR y OR?: si = 1 indican que no existe asociación; si >1 indican que existe una asociación positiva y deben ir acompañadas de su IC; aunque todo RR u OR cuyo IC no comprenda el 1 se considera estadísticamente significativo, su importancia clínica depende del tipo de estudio de donde proceda. Debido a los sesgos en los estudios de casos y controles es deseable que la OR alcance un valor > 4 para deducir su relevancia en la práctica clínica; puesto que los estudios de cohortes son menos propensos a los sesgos puede ser convincente para el clínico con RR >3; debido a que los EC aleatorizados están relativamente exentos de sesgos, cualquier RR cuyo IC excluya 1 es convincente.
La reducción relativa del riesgo (RRR) es la diferencia entre el porcentaje de eventos en el grupo control y el porcentaje de eventos en el grupo experimental, dividido por el porcentaje de eventos en el grupo control. Tiene una limitación: no es capaz de diferenciar entre los grandes efectos absolutos de un tratamiento de los efectos más pequeños; para solventar este problema está la reducción absoluta del riesgo (RAR) que es la diferencia entre el porcentaje de eventos en el grupo control y el porcentaje de eventos en el grupo experimental. La RAR sí que tiene en cuanta la susceptibilidad basal de los pacientes y da más información detallada que la RRR.
Una vez que el clínico está convencido tanto de la validez como de la asociación, necesita convertir estos datos en alguna medida de impacto, siendo la medida principal el Número Necesario de pacientes a Tratar (NNT), que se obtiene como el inverso de la RAR. El NNT mide el “esfuerzo” terapéutico que debe realizarse para prevenir un suceso indeseable adicional. Pero el NNT obtenido, ¿es grande o pequeño?: como en muchas otras cuestiones en medicina la expuesta está relacionada con el significado clínico (depende del precio, facilidad de cumplimiento e inocuidad del tratamiento) y no con el significado estadístico, y deberán emplearse IC en torno al NNT. Es una medida muy útil del esfuerzo clínico que deberemos hacer para ayudar a evitar un resultado adverso. Por ello se deben mostrar (o calcular) los NNT en los resultados de los artículos sobre tratamiento, siempre que sea posible.
Otra característica útil del NNT, es la facilidad con la que los lectores pueden convertir a NNT los datos dentro de la práctica habitual. Lo que hay que hace es estimar el riesgo basal del propio paciente en relación con el paciente control promedio de EC estudiado, y expresar esta estimación como una fracción decimal, que llamaremos F: si el lector juzga que su paciente es dos veces más susceptible que el paciente control promedio de la publicación, entonces F = 2, y si su paciente le parece la mitad de susceptible, entonces F = 0,5, y si le parece tan susceptible como los pacientes de la publicación, entonces F = 1: Si el tratamiento produce una RRR constante en todo el espectro de susceptibilidades el NNT de su paciente es calculado dividiendo el NNT entre F.
Las expresiones RRR, RAR y NNT valoran la magnitud de una intervención para producir un efecto beneficioso. Las expresiones que valoran la magnitud de una intervención para producir un efecto indeseable son el incremento relativo del riesgo (IRR), incremento absoluto del riesgo (IRA) y número necesario de pacientes a dañar (NND).
En la tabla 2 se presenta un ejemplo hipotético respecto la cálculo de las medidas del efecto de una intervención terapéutica.
Tabla 2. Medidas del efecto de una intervención terapéutica Mostrar/ocultar
El IC nos ofrece una medida de precisión con la que se ha estimado el parámetro poblacional a partir de la simple estimación puntual obtenida a partir de una muestra de pacientes. Los dos valores que definen el IC se llaman límites de confianza, y se suele utilizar arbitrariamente el valor del 95%; un IC es más preciso cuanto más estrecho es. Pueden elaborarse IC para la mayoría de estimaciones o comparaciones estadísticas (OR, RR, RRR, RAR, NNT) y si los autores no aportan los IC, a menudo estos pueden obtenerse de los resultados expuestos en el estudio.
3. ¿Son aplicables en tu medio?
El hecho de que un tratamiento determinado sea apropiado, no significa que todos los pacientes deban recibir el tratamiento. Para ellos nos podemos preguntar9:
- ¿Son aplicables los resultados a nuestros pacientes?: no se trata simplemente de determinar si las características de los sujetos del EC y los de nuestra consulta son diferentes, sino si estas diferencias pueden hacer sospechar que se obtendrían resultados distintos. Algunos aspectos a tener en cuenta para valorar la aplicabilidad de los resultados de un EC son: 1) aspectos biológicos: ¿existen diferencias fisiopatológicas en la enfermedad que puedan conducir a una menor respuesta al tratamiento?, ¿existen diferencias en algunas características del paciente que puedan disminuir la respuesta al tratamiento?; 2) aspectos sociales y económicos: ¿existen diferencias importantes en el cumplimiento por parte del paciente que puedan disminuir la respuesta al tratamiento?, ¿existen diferencias importantes en el cumplimiento por parte del profesional que puedan disminuir la respuesta al tratamiento?; 3) aspectos epidemiológicos: ¿el paciente tiene otros problemas de salud concomitantes que puedan alterar significativamente los riesgos y beneficios del tratamiento?
-
¿Son aplicables los resultados a nuestros pacientes?: no se trata simplemente de determinar si las características de los sujetos del EC y los de nuestra consulta son diferentes, sino si estas diferencias pueden hacer sospechar que se obtendrían resultados distintos. Algunos aspectos a tener en cuenta para valorar la aplicabilidad de los resultados de un EC son: 1) aspectos biológicos: ¿existen diferencias fisiopatológicas en la enfermedad que puedan conducir a una menor respuesta al tratamiento?, ¿existen diferencias en algunas características del paciente que puedan disminuir la respuesta al tratamiento?; 2) aspectos sociales y económicos: ¿existen diferencias importantes en el cumplimiento por parte del paciente que puedan disminuir la respuesta al tratamiento?, ¿existen diferencias importantes en el cumplimiento por parte del profesional que puedan disminuir la respuesta al tratamiento?; 3) aspectos epidemiológicos: ¿el paciente tiene otros problemas de salud concomitantes que puedan alterar significativamente los riesgos y beneficios del tratamiento?
Puede ocurrir que se presenten análisis de subgrupos de sujetos, alguno de los cuales sea similar a los pacientes a los que se desea aplicar el resultado, por lo que se estaría tentado a extrapolarlo directamente; sin embargo, el análisis de subgrupos puede ser peligroso, ya que la realización de múltiples comparaciones aumenta la probabilidad de encontrar un resultado estadísticamente significativo simplemente por azar; por otro lado, si los subgrupos son de reducido tamaño, el análisis puede ser incapaz de detectar diferencias relevantes. Cuando un estudio presenta análisis de subgrupos hay que ser muy cauteloso al interpretarlos, y evaluar detenidamente si el efecto es de gran magnitud, si el tamaño del subgrupo es grande, si responde a una hipótesis establecida previamente al inicio del estudio, si se han analizado pocos subgrupos, si se han observado los mismo resultados en otros estudios y si existe un mecanismo plausible que lo explique (si no se cumplen estas circunstancias, hay que ser escéptico sobre la posibilidad de aplicar los resultados). - ¿Cuál sería el beneficio potencial de la aplicación de la intervención en este paciente?: para que decidamos aplicar una determinada intervención se debe estar convencido de que producirá un beneficio para el paciente. Este aspecto es importante cuando los estudios utilizan una variable intermedia para evaluar el efecto de la intervención; no basta con demostrar que un tratamiento tiene un efecto fisiológico potencialmente beneficioso para asumir que su administración también lo será. De hecho, solamente debería recomendarse un tratamiento en función de su efecto sobre una variable intermedia cuando el riesgo del paciente es elevado, el paciente valora en alto grado evitar el suceso adverso y no existen intervenciones alternativas satisfactorias. Cuando la intervención que se evalúa es la detección precoz de una enfermedad, debe asegurarse que existe un tratamiento eficaz para la enfermedad que se detecta.
- ¿Se han considerado todos los posibles resultados clínicamente importantes?: no es necesario evaluar sólo la respuesta adecuada, sino todas las otras posibles respuestas o efectos de relevancia clínica que puede producir el tratamiento, como su impacto sobre la calidad de vida de los sujetos.
- ¿Compensan los beneficios del tratamiento, los costes y riesgos del mismo?: cuando se trata de una intervención sanitaria sencilla, sin riesgos y que es muy eficaz en la reducción de la mortalidad o la prevención de una enfermedad grave, la decisión es fácil. Pero en otras ocasiones se requiere una discusión detallada de todos los aspectos relacionados con la intervención, su cumplimiento y sus potenciales efectos beneficiosos y perjudiciales previamente a la toma de decisiones. Señalar que la consideración de beneficios y perjuicios no puede guiarse exclusivamente por medidas cuantitativas de impacto; también deben tenerse en cuenta la repercusión clínica de los mismos y por supuesto el coste, facilidad de aplicación, grado de cumplimiento y accesibilidad de la intervención considerada.
- ¿La intervención y sus consecuencias satisfacen los valores y preferencias de los pacientes?: cada día se da mayor importancia a este aspecto, pues hemos asistido a un cambio importante en las relaciones médico-paciente, consecuencia del enfoque de la relevancia de los consumidores en la sociedad. Los pacientes han pasado a ser considerados coproductores de los cuidados de salud y, como tales, han adoptado un papel diferente, considerándose ahora necesario contar con su opinión y promover en ellos decisiones responsables sobre su salud.
Cómo citar este artículo
González de Dios J, González Rodríguez P. Evaluación de artículos científicos sobre intervenciones terapéuticas. Evid Pediatr. 2006;2:90
Bibliografía
- Akobeng AK. Understanding randomized controlled trials. Arch Dis Child. 2005;90:840-4.
- Deveraux PJ, Yusuf S. The evolutin of the randomized controlled trial and its role in evidnece-based decision making. J Intern Med. 2003;254:105-13.
- González de Dios J. Las mejores evidencias (o pruebas) científicas (I): el ensayo clínico. Rev Esp Pediatr. 1.999;55:157-65.
- Evidence-Based Medicine Working Group. User´Guides to the Medical Literature. II How to Use an Article About Therapy or Prevention. A. Are the results of the study valid? JAMA. 1993;270:2598-601.
- Evidence-Based Medicine Working Group. User´ Guides to the Medical Literature. II How to Use an Article About Therapy or Prevention. B. What were the results and will they help me in caring for my patients? JAMA. 1994;271:59-63.
- González de Dios J. Revisión crítica de publicaciones sobre tratamiento. Pediatr Integral. 2002;6:455-62.
- González de Dios J. Lectura crítica de documentos científicos. An Pediatr Contin. 2003;1:51-5.
- Strauss SE, Richardson WS, Glasziou P, Haynes RB. Medicina basada en la evidencia. Como practicar y enseñar la MBE. 3ª edición. Madrid: Elsevier España; 2006.
- González de Dios J. Aplicabilidad de los resultados de nuestra valoración crítica de documentos a nuestra práctica clínica. Pediatr Integral. 2003;7:239-40.


Envío de comentarios a los autores