Toma de decisiones clínicas basadas en pruebas científicas
EVIDENCIAS EN PEDIATRÍA
Diciembre 2011. Volumen 7. Número 4
| Listas guía de comprobación de revisiones sistemáticas y metaanálisis: declaración PRISMA
Valoración: 0 (0 Votos)Autores: González de Dios J, Buñuel Álvarez JC, Aparicio Rodrigo M.
 Suscripción gratuita al boletín de novedades
Suscripción gratuita al boletín de novedades
Reciba periódicamente por correo electrónico los últimos artículos publicados
Suscribirse |
Autores:
Correspondencia:
Declaración PRISMA: prototipo de lista guía de comprobación para ensayos clínicos
Dentro del arsenal de estudios y publicaciones científicas, las revisiones sistemáticas (RS) y metaanálisis (MA) tienen gran valor (y popularidad) en el ciclo de generación, transmisión e implementación del conocimiento, tanto por su valor per se como por ser el punto de partida de guías de práctica clínica y/o informes de evaluación de tecnologías sanitarias1. Las RS (con o sin MA) han experimentado un auge considerable en los últimos años y plantean una diferencia sustancial con las revisiones narrativas o de autor (tabla 1).
Tabla 1. Diferencias entre revisión narrativa (o de autor) y revisión sistemática Mostrar/ocultar
Aunque no todas las RS están volcadas en La Colaboración Cochrane, sí podemos considerar su base de datos de RS como la más importante, tanto en cantidad como en calidad metodológica. Una RS se encuentra en el segundo escalón de la pirámide de las “6S” de Haynes (Syntheses)2, pero una RS no es buena per se (como tampoco lo será un ensayo clínico) y, para poder valorarla, debe describir de forma completa y transparente su metodología.
La existencia desde 1999 de la declaración Quality of Reporting of Meta-analyses (QUOROM)3 para la publicación de MA de estudios aleatorizados abrió el camino a la mejora en la calidad de su publicación. Después de tres años de trabajo, QUOROM apareció como una lista de comprobación estructurada de 18 ítems (y que incluía un diagrama de flujo) cuyo objetivo era proporcionar toda aquella información que resulta esencial para escribir, interpretar y utilizar adecuadamente los resultados en un MA4. La declaración QUOROM no logró la misma aceptación por parte de los editores de revistas que la declaración CONSORT, de la que hablamos en nuestro capítulo anterior de la serie Fundamentos5; se comenta que una de las causas de esta menor implantación podría ser que no se han realizado suficientes estudios que demuestren su impacto en la mejoría de la calidad de los MA después de su difusión.
Ya en el momento de su publicación, el grupo de trabajo de QUOROM estableció la necesidad de que debiera ser actualizado periódicamente. Actualizar QUOROM ha sido una labor que se ha llevado a cabo durante varios años por un heterogéneo grupo de 29 profesionales de distintos países con el nombre de grupo PRISMA (Preferred Reporting Items for Systematic Reviews and Meta-Analyses), y en el que han tenido una labor fundamental distintas universidades (Otawa, Oxford, Módena, McMaster, Friburgo, Maastricht, San Francisco,...), centros Cochrane (Oxford, Italia, Noruega, ....), así como la International Network of Agencies for Health Technology Assessment (INAHTA) o Guideline International Network (GIN). Cabe señalar que la elaboración y la publicación de PRISMA ha coincidido en el tiempo con la actualización y la modificación sustancial del Cochrane Handbook for Systematic Reviews of Interventions (versión 5), cuya finalidad principal es ayudar a los autores de revisiones Cochrane a ser sistemáticos y explícitos en el desarrollo de éstas. No en vano muchos de los autores del grupo de trabajo PRISMA están también involucrados como asesores metodológicos de la Colaboración Cochrane.
La declaración PRISMA es una lista de comprobación con 27 puntos (frente a los 18 de QUOROM) y un diagrama de flujo de cuatro fases que podemos revisar en su publicación original6 o bien en el reciente artículo publicado en Medicina Clínica por dos miembros del Centro Cochrane Iberoamericano7. PRISMA se convierte así en un avance significativo: a diferencia de QUOROM, la declaración PRISMA viene acompañada de un extenso documento donde se detalla la explicación o la justificación de cada uno de los 27 ítems propuestos, así como el proceso de elaboración de estas directrices a partir de siete cuadros explicativos sobre ciertos aspectos clave de las RS.
Los autores de PRISMA identifican cuatro aspectos conceptuales novedosos que conllevan la adición de nuevos ítems a la lista de comprobación6,7:
- El carácter iterativo del proceso de desarrollo de una RS, dado que es muy importante que los métodos que utilice la revisión se establezcan y se documenten a priori.
- La conducción y la publicación de un estudio de investigación son conceptos distintos.
- Evaluación del riesgo de sesgo de los estudios o de los resultados.
- Importancia de los sesgos de publicación, bien por omisión de estudios completos o por omisión de resultados dentro de un estudio individual.
De esta forma, y comparado con QUOROM, los cambios más relevantes introducidos en la lista de comprobación de PRISMA son6,7:
- En el título: PRISMA solicita la identificación de la publicación como RS, MA o ambos, mientras que QUOROM se refería exclusivamente a MA de ensayos clínicos.
- En el resumen: tanto QUOROM como PRISMA solicitan a los autores un resumen estructurado, pero PRISMA no especifica su formato, aunque sí hace recomendaciones.
- En la introducción: incluye el ítem 4 (objetivo), que se focaliza en la pregunta explícita que aborda la revisión utilizando el formato PICO (descripción de los participantes, las intervenciones, las comparaciones y las medidas de resultado de la revisión sistemática), así como el tipo de estudio (diseño).
- En el apartado de Métodos es donde encontramos mayores cambios: incluye el ítem 4 (protocolo) en el que se solicita al autor que explique si un protocolo precedió la revisión y, en tal caso, cómo puede accederse a éste. Así mismo, PRISMA desdobla el ítem sobre la «búsqueda» de QUOROM en 2 ítems: a) fuentes de información (ítem 7) y b) búsqueda (ítem 8). Aunque la estrategia de búsqueda se reporta tanto en QUOROM como en PRISMA, éste último solicita a los autores que proporcionen la descripción completa de, al menos, una estrategia de búsqueda electrónica (ítem 8). También es importante la evaluación del riesgo de sesgo en los estudios incluidos: en QUOROM este ítem aparecía como «evaluación de la calidad», pero ahora este ítem12 se focaliza en la evaluación del riesgo de sesgo dentro de cada estudio incluido en la RS y también se introduce el nuevo concepto de evaluación del sesgo al nivel de los resultados (ítem 19).
En la tabla 2 se esquematizan estas diferencias entre PRISMA y QUOROM.
Tabla 2. Diferencias más relevantes entre declaración PRIMAS y QUOROM Mostrar/ocultar
Como decíamos previamente, uno de los retos reales de esta nueva lista de comprobación será poder evaluar las ventajas (calidad mejorada de la publicación) y las posibles limitaciones (aumento de la extensión del texto) de PRISMA en la publicación de RS y/o MA. Durante el proceso de presentación del manuscrito, los editores pueden exigir a los autores completar la lista de comprobación de PRISMA e incluirla como parte del proceso de remisión del artículo. A su vez, en la fase de revisión, los editores pueden sugerir a los revisores usar la lista para guiarlos durante la evaluación del artículo. Finalmente, los editores pueden utilizar PRISMA durante la fase de decisión editorial.
Con esta nueva lista de comprobación, a partir de ahora, las RS y MA no serán buenos per se, sino que “dependerán del PRISMA con que se miren”. Disponemos ya del “prisma”; resta utilizarlo y demostrar que mejora la calidad de las RS y/o MA.
La declaración PRISMA paso a paso, ítem a ítem
A continuación exponemos los 27 ítems de la declaración PRIMSA6,7. Éstos se clasifican en siete secciones, que son las clásicas IMRD de cualquier artículo original (Introducción, Métodos, Resultados y Discusión), con dos secciones previas (Título y Resumen) y una posterior (Financiación).
A continuación, y basándonos en la “explicación y elaboración” anexa a cada ítem, se exponen las características más interesantes de cada uno. Toda la información está disponible en su web: http://www.prisma-statement.org/
Este es el “prisma” actual con el que hay que elaborar, revisar y valorar las RS y MA, dos artículos esenciales en el contexto de “infoxicación” en el que nos movemos. Ya hemos hablado en esta sección de los conceptos básicos de las RS y MA8 y de su valoración crítica9. Ahora es el momento de agrupar estos conocimientos y encuadrarlos en la declaración PRISMA. Una buena herramienta.
-
Título y resumen
-
1. Título.
Identificar la publicación como RS, MA o ambas. Si se especifica que se trata de una revisión sobre ensayos clínicos ayudará a priorizarla frente a otras revisiones.
-
1. Título.
-
Resumen
-
2. Resumen estructurado.
Que incluya: antecedentes; objetivos; fuente de los datos; criterios de elegibilidad de los estudios, participantes e intervenciones; evaluación de los estudios y métodos de síntesis; resultados; limitaciones; conclusiones e implicaciones de los hallazgos principales; número de registro de la RS.
-
2. Resumen estructurado.
-
Introducción
-
3. Justificación.
Implica describir lo que se conoce del tema y comentar la necesidad de la RS haciendo referencia a la importancia del problema y a la controversia existente sobre las intervenciones que se desea revisar. -
4. Objetivos.
Plantear de forma explícita las preguntas que se desea contestar en relación con los participantes, las intervenciones, las comparaciones, los resultados y el diseño de los estudios (acrónimo PICOS).
-
3. Justificación.
-
Métodos
-
5. Protocolo y registro.
Indicar si existe un protocolo de revisión al que se pueda acceder (por ej., dirección web) y, si está disponible, la información sobre el registro, incluyendo su número de registro. -
6. Criterios de elegibilidad.
Especificar las características de los estudios (por ej., cada uno de los elementos del acrónimo PICOS, duración del seguimiento) y de las características de la búsqueda (por ej., años abarcados, idiomas o estatus de publicación) utilizadas como criterios de elegibilidad y su justificación. -
7. Fuentes de información.
Describir todas las fuentes de información (por ej., bases de datos y períodos de búsqueda, contacto con los autores para identificar estudios adicionales, etc.) y la fecha de la última búsqueda realizada. -
8. Búsqueda.
Presentar la estrategia completa de búsqueda electrónica en, al menos, una base de datos, incluyendo los límites utilizados, de tal forma que pueda ser reproducible. -
9. Selección de los estudios.
Especificar el proceso de selección de los estudios, con los criterios de inclusión y exclusión. Definir la elegibilidad de los estudios incluidos en la RS y, cuando sea pertinente, en el MA. -
10. Proceso de extracción de datos.
Describir los métodos para la extracción de datos de las publicaciones (por ej., formularios pilotados, por duplicado y de forma independiente) y cualquier proceso para obtener y confirmar datos por parte de los investigadores. -
11. Lista de datos.
Listar y definir todas las variables para las que se buscaron datos (por ej., PICOS, fuente de financiación) y cualquier asunción y simplificación que se hayan hecho. -
12. Riesgo de sesgo en los estudios individuales.
Describir los métodos utilizados para evaluar el riesgo de sesgo en los estudios individuales (especificar si se realizó a nivel de los estudios o de los resultados) y cómo esta información se ha utilizado en la síntesis de datos. -
13. Medidas de resumen.
Especificar las principales medidas de resumen (por ej., razón de riesgos o diferencia de medias). -
14. Síntesis de resultados.
Describir los métodos para manejar los datos y combinar resultados de los estudios, cuando esto es posible, incluyendo medidas de consistencia para cada MA. -
15. Riesgo de sesgo entre los estudios.
Especificar cualquier evaluación del riesgo de sesgo que pueda afectar la evidencia acumulativa (por ej., sesgo de publicación o comunicación selectiva). -
16. Análisis adicionales.
Describir los métodos adicionales de análisis (por ej., análisis de sensibilidad o de subgrupos, metarregresión), en el caso de que se hiciera, indicar cuáles fueron preespecificados.
-
5. Protocolo y registro.
-
Resultados
-
17. Selección de estudios.
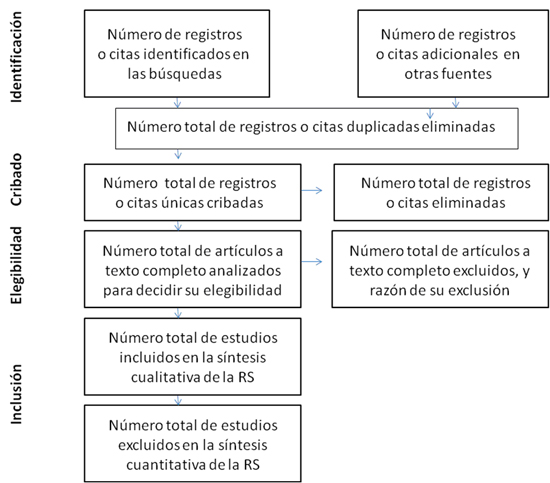
Facilitar el número de estudios cribados, evaluados para su elegibilidad e incluidos en la RS, y detallar las razones para su exclusión en cada etapa, idealmente mediante un diagrama de flujo. El diagrama de flujo se convierte en un elemento esencial en las RS, en donde se valora el número de registros en cada etapa: identificación, cribado, elegibilidad e inclusión (ver figura 1).
Figura 1. Diagrama de flujo de la información a través de las diferentes fases de una revisión sistemática Mostrar/ocultar
-
18. Características de los estudios.
Para cada estudio presentar las características para las que se extrajeron los datos (por ej., tamaño, PICOS y duración del seguimiento) y proporcionar las citas bibliográficas. -
19. Riesgo de sesgo en los estudios.
Presentar datos sobre el riesgo de sesgo en cada estudio y, si está disponible, cualquier evaluación del sesgo en los resultados (ver ítem 12). -
20. Resultados de los estudios individuales.
Para cada resultado considerado en cada estudio (beneficios o daños), presentar: a) el dato resumen para cada grupo de intervención y b) la estimación del efecto con su intervalo de confianza, idealmente de forma gráfica mediante un diagrama de bosque (forest plot). -
21. Síntesis de los resultados.
Presentar los resultados de todos los MA realizados, incluyendo los intervalos de confianza y las medidas de consistencia. -
22. Riesgo de sesgo entre los sujetos.
Presentar los resultados de cualquier evaluación del riesgo de sesgo entre los estudios (ver ítem 15). -
23. Análisis adicionales.
Facilitar los resultados de cualquier análisis adicional, en el caso de que se hayan realizado (por ej., análisis de sensibilidad o de subgrupos, metarregresión (ver ítem 16).
-
17. Selección de estudios.
-
Discusión
-
24. Resumen de la evidencia.
Resumir los hallazgos principales, incluyendo la fortaleza de las evidencias para cada resultado principal; considerar su relevancia para grupos clave (por ej., proveedores cuidados, usuarios y decisores en salud). -
25. Limitaciones.
Discutir las limitaciones de los estudios y de los resultados (por ej., riesgo de sesgo) y de la revisión (por ej., obtención incompleta de los estudios identificados o comunicación selectiva. -
26. Conclusiones.
Proporcionar una interpretación general de los resultados en el contexto de otras evidencias, así como las implicaciones para la futura investigación. En las RS/MA es esencial los apartados finales de “implicaciones para la práctica clínica” e “implicaciones para la investigación”.
-
24. Resumen de la evidencia.
-
Financiación
-
27. Financiación.
Describir las fuentes de financiación de la RS y otro tipo de apoyos (por ej.,aporte de los datos), así como el papel de los financiadores en la RS.
-
27. Financiación.
Cómo citar este artículo
González de Dios J, Buñuel Álvarez JC, Aparicio Rodrigo M. Listas guía de comprobación de revisiones sistemáticas y metaanálisis: declaración PRISMA. Evid Pediatr. 2011;7:97.
Bibliografía
- Moher D, Liberati A. Revisiones sistemáticas y metaanálisis: la responsabilidad de autores, revisores, editores y patrocinadores. Med Clin (Barc). 2010;135:505-6.
- DiCenso A, Bayley L, Haynes RB. ACP Journal Club. Editorial: Accessing preappraised evidence: fine-tuning the 5S model into a 6S model. Ann Intern Med. 2009;151:JC3-2, JC3-3.
- Moher D, Cook DJ, Eastwood S, Olkin I, Rennie D, Stroup DF. Improving the quality of reports of meta-analyses of randomised controlled trials: the QUOROM statement. Quality of Reporting of Meta-analyses. Lancet. 1999;354:1896-900.
- Urrutia G, Tort S, Bonfill X. Metaanálisis (QUOROM). Med Clin (Barc). 2005;125(Supl 1):32-7.
- González de Dios J, Buñuel Álvarez JC, González Rodríguez P. Listas guía de comprobación de ensayos clínicos: declaración CONSORT. Evid Pediatr. 2011;7:72.
- Moher D, Liberati A, Tetzlaff J, Altman DG, The PRISMA Group. Preferred Reporting Items for Systematic Reviews and Meta-Analyses: The PRISMA Statement. PLoS Med 2009;6(7):e1000097.
- Urrútia G, Bonfill X. Declaración PRISMA: una propuesta para mejorar la publicación de revisiones sistemáticas y metaanálisis. Med Clin (Barc). 2010;135:507-11.
- González de Dios J, Balaguer Santamaría A. Revisión sistemática y metaanálisis (I): conceptos básicos. Evid Pediatr. 2007;3:107.
- González de Dios J, Balaguer Santamaría A. Revisión sistemática y metanalisis (II): evaluación crítica de la revisión sistemática y metánalisis. Evid Pediatr. 2008;4:19.


Envío de comentarios a los autores