Toma de decisiones clínicas basadas en pruebas científicas
EVIDENCIAS EN PEDIATRÍA
Diciembre 2009. Volumen 5. Número 4
| Evaluación Económica en Medicina (II): métodos de evaluación económica y manejo de la incertidumbre asociada
Valoración: 0 (0 Votos)Autores: Valladares A, González de Dios J, Sacristán JA.
 Suscripción gratuita al boletín de novedades
Suscripción gratuita al boletín de novedades
Reciba periódicamente por correo electrónico los últimos artículos publicados
Suscribirse |
Autores:
Correspondencia:
Tras el primer artículo de la serie “Evaluación Económica en Medicina (I): Fundamentos y Metodología”1 el objetivo de este artículo es ofrecer una visión general sobre los principales métodos de investigación a partir de los cuales se realiza una evaluación económica (ensayos clínicos, estudios observacionales y modelos basados en análisis de decisión), así como sobre las técnicas utilizadas para valorar hasta qué punto la incertidumbre afecta a los resultados de un análisis económico. A continuación, estos aspectos se analizarán en el contexto de las evaluaciones económicas de intervenciones sanitarias (EEIS) realizadas en población pediátrica en España.
Evaluaciones económicas en los ensayos clínicos
Los ensayos clínicos pueden diseñarse para recoger prospectivamente información clínica y económica, mediante la inclusión de un apartado de utilización de recursos sanitarios. Estos ensayos clínicos que incorporan una evaluación económica se denominan en inglés piggy-back clinical trials. La principal ventaja de las evaluaciones económicas incorporadas a los ensayos clínicos deriva del rigor científico del propio método, que permite obtener resultados con una alta validez interna. Sin embargo, a pesar del rápido crecimiento observado en la introducción de la evaluación económica en ensayos clínicos, éstos presentan algunas limitaciones si se utilizan como única fuente de información2,3:
- El ensayo clínico es un método de investigación que determina los efectos de las intervenciones sanitarias en condiciones experimentales, es decir, su eficacia. Sin embargo, la evaluación económica pretende determinar la relación entre los costes y los efectos cuando dichas intervenciones son utilizadas en condiciones reales, y por tanto, debería incorporar datos de efectividad.
- Debido al uso de criterios restrictivos de inclusión y exclusión, y al seguimiento exhaustivo y monitorización, los resultados obtenidos en los ensayos clínicos pueden no ser generalizables a la población de pacientes a la que se tratará una vez que se comercialice la nueva tecnología sanitaria, por lo que validez externa de sus resultados es escasa.
- La utilización de los recursos está condicionada por el protocolo del ensayo y en ocasiones es difícil diferenciarlos de los que se producirían en la práctica clínica habitual.
- En algunos casos, los comparadores del ensayo clínico no representan el tratamiento habitual de la patología en la práctica clínica habitual.
- Dada la dificultad para evaluar los efectos en resultados finales, los ensayos clínicos normalmente miden variables clínicas intermedias, tales como el colesterol sérico, la ausencia de infección o el tamaño del tumor. Sin embargo, para realizar un análisis económico es preferible saber qué impacto tendrán estos cambios sobre los resultados finales en salud, como la mortalidad o la morbilidad.
- El horizonte temporal suele ser demasiado corto para el adecuado seguimiento de los pacientes desde el punto de vista de los costes y resultados en la salud.
- El tamaño muestral se calcula basándose en los objetivos principales (normalmente eficacia y toxicidad) del estudio. Sin embargo, las variables económicas pueden tener una variabilidad mayor que las clínicas, motivo por el cual la potencia estadística del ensayo clínico es, con frecuencia, insuficiente para establecer diferencias económicas estadísticamente significativas.
Por tanto, los ensayos clínicos con objetivos económicos deberían contar con diseños pragmáticos o naturalísticos, es decir, estudios que intenten simular lo que ocurre en la práctica clínica, que busquen datos de efectividad y que tengan principalmente las siguientes características3:
- Deben realizarse en un ámbito sanitario estándar, similar al medio en el que se utilizará el medicamento o la intervención sanitaria una vez que se comercialice.
- Los criterios de inclusión y exclusión de pacientes deben ser acordes con la práctica clínica real, aumentando así su validez externa.
- Las opciones comparadas deben ser las más eficientes o las más utilizadas en la práctica clínica.
- Aunque conservan la asignación aleatoria de los sujetos a los tratamientos para minimizar el sesgo, deberían ofrecer menos restricciones tras la ubicación aleatoria, permitiendo por ejemplo, modificar las dosis o cambiar el tratamiento según el criterio médico.
- En las enfermedades con consecuencias a largo plazo debe hacerse un seguimiento prolongado de los pacientes.
Evaluaciones económicas en estudios observacionales
Las EEIS pueden realizarse en el marco de estudios epidemiológicos más o menos complejos, aunque casi siempre se plantean a partir de análisis de la información de historias clínicas y de bases de datos administrativas que contienen información sobre la utilización de recursos, los tratamientos prescritos, las características demográficas de los pacientes, etc.3
Los estudios observacionales pueden clasificarse en función de la presencia o no de un grupo control3:
- Estudios descriptivos: ausencia de control.
- Estudios analíticos: con grupo control.
- Estudios transversales, tanto la exposición como los eventos se evalúan simultáneamente.
- Estudios de cohortes, el estudio comienza con la selección de individuos expuestos y no expuestos que son seguidos en el tiempo pata determinar la ocurrencia de los eventos.
- Estudios de casos y controles, el estudio comienza con la selección de los individuos en función de que presenten el evento en cuestión o no y se evalúa retrospectivamente la presencia de la exposición.
Asimismo, según la temporalidad en la recogida de la información se pueden clasificar en prospectivos o retrospectivos. Los estudios retrospectivos se plantean a partir de análisis de información procedente de historias clínicos o bases de datos.
La mayor ventaja de los análisis económicos realizados a partir de bases de datos es el gran volumen de información de que puede disponerse, de forma rápida y barata. Desde el punto de vista metodológico, los resultados son muy representativos de lo que sucede a la mayoría de los pacientes, lo que posibilita el estudio de subgrupos de pacientes y de enfermedades raras3.
Sus principales problemas son los derivados de su menor validez interna, debido a la ausencia de asignación aleatoria, la posible baja calidad de la información, la falta de datos sobre los efectos de un determinado tratamiento, y la presencia de datos incompletos, mal codificados o erróneos3,4.
Cuando las intervenciones sanitarias, y en concreto, los fármacos ya se han comercializado, la realización de estudios observacionales que aporten nuevos datos sobre efectividad en condiciones reales, debería servir de base para su re-evaluación, una vez que su uso en la práctica clínica habitual haya ajustado su dosis, duración de tratamiento, y seleccionando mejor a los pacientes que más pueden beneficiarse de la intervención.
Evaluaciones económicas mediante modelización
Un modelo puede definirse como un esquema teórico, generalmente en forma matemática, de un sistema o de una realidad compleja, que se elabora para facilitar su comprensión y el estudio de su comportamiento. Los modelos permiten hacer simulaciones de realidades complejas e inciertas, como son los procesos sanitarios relacionados con los medicamentos u otras intervenciones sanitarias, con el objetivo de proponer explicaciones para éstos, prever su evolución y facilitar la toma de decisiones5,6.
Los modelos farmacoeconómicos constituyen una particularidad de los modelos de decisión, y tienen como objetivo comparar la eficiencia de varias alternativas terapéuticas o preventivas, generalmente fármacos. Para ello, tratan de aproximarse a las condiciones de uso de los tratamientos farmacológicos en la práctica real con el fin de determinar y evaluar su impacto en términos de resultados de salud y costes7.
Los modelos deben verse como instrumentos de ayuda para la toma de decisiones cuando la información necesaria para analizar todas las consecuencias clínicas y económicas de una decisión clínica es insuficiente y no permite extraer conclusiones directas. Las limitaciones de los ensayos clínicos anteriormente expuestas son las que justifican la utilización de modelos en farmacoeconomía, donde factores distintos a los observados en situaciones experimentales son fundamentales para la evaluación de opciones de tratamientos alternativas. El uso de los modelos es necesario cuando8:
- La medida de eficacia disponible se limita a resultados intermedios que no permiten calcular variables finales o clínicamente relevantes.
- Las alternativas estudiadas en los ensayos clínicos no se corresponden con las alternativas relevantes en la evaluación económica.
- La historia natural de la enfermedad se extiende más allá de la duración del ensayo clínico y se considera relevante incorporar a la evaluación económica los efectos a largo plazo de la intervención estudiada.
- El perfil de los pacientes de interés para la evaluación económica no se corresponde con el de los pacientes de los ensayos clínicos.
Los modelos nos van a permitir extrapolar, adoptar e integrar los resultados de los ensayos clínicos utilizando información procedente de registros hospitalarios, bases de datos, opiniones de expertos, revisión de historias clínicas, estudios epidemiológicos, entre otros (Tabla 1)9.
Tabla 1. Utilidad de la modelización en farmacoeconomía (adaptado de Brosa9). Mostrar/ocultar
Existen diferentes formas de clasificar los modelos económicos10, pero las más utilizadas lo hacen en función de su estructura o de su naturaleza probabilística:
a)Según su estructura
-
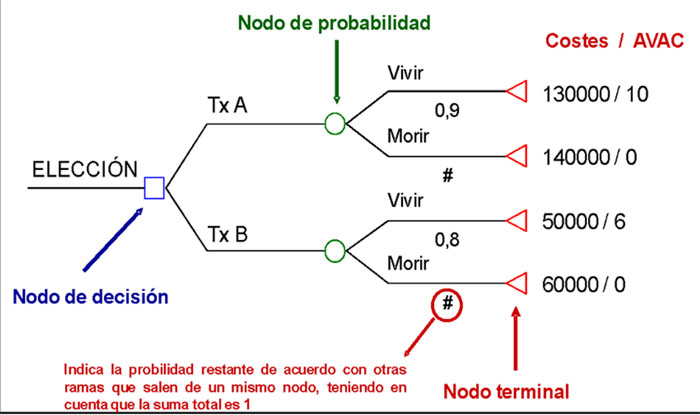
Modelos basados en árboles de decisión5,11,12: es un método cuantitativo y sistemático de representación de una situación clínica cuyo objetivo es realizar una simulación o proyección de todas las posibilidades (con sus respectivas probabilidades) que pueden ocurrir tras la administración o aplicación de distintas alternativas sanitarias.
Se caracterizan gráficamente por un conjunto de ramas (que representan las diferentes decisiones y sus consecuencias) que parten de nodos. Estos nodos son el punto que da origen o del que nace el árbol (nodo de acción/decisión/elección), puntos de los que parten los acontecimientos o resultados consecuencia de cada decisión (nodos de acontecimiento/azar/probabilidad), o puntos en los que desembocan los resultados finales de cada intervención (nodos terminales) (Figura 1).
Son apropiados en situaciones en las que los eventos ocurren en un periodo de tiempo limitado. Sin embargo, presentan inconvenientes cuando se quiere representar eventos recursivos, eventos cuyas probabilidades de ocurrencia cambian con el tiempo, eventos que no ocurren inmediatamente o eventos que tienen implicaciones a largo plazo en los pacientes. Además, en determinadas patologías, la necesidad de reflejar un gran número de posibles consecuencias a lo largo del tiempo puede dar lugar a árboles de decisión demasiado complejos, difíciles de programar y de representar.
Figura 1. Árbol de decisión Mostrar/ocultar
-
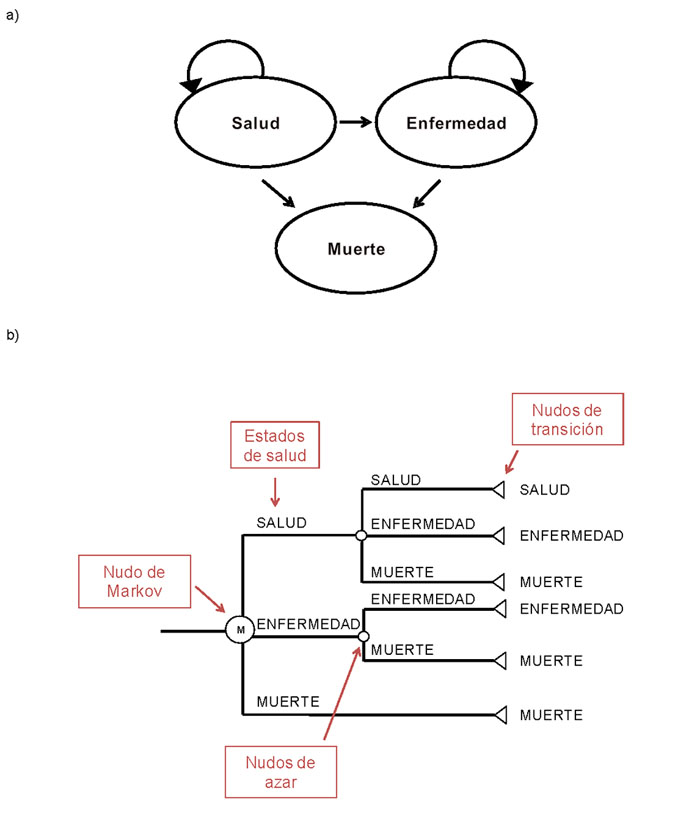
Modelos de Markov5,12,13: es una técnica matemática de modelización derivada del álgebra matricial, que describe la transición de un individuo o un conjunto de individuos (cohorte) por diferentes estados de salud a lo largo de un periodo de tiempo discreto, replicando la historia natural de la enfermedad.
En los modelos de Markov, la enfermedad en cuestión se divide en un conjunto finito de estados de salud (por ejemplo: salud perfecta, salud deteriorada, fallecimiento) (Figura 2). Pueden diferenciarse tres tipos:
Figura 2. Representaciones gráficas de los modelos de Markov. A: como diagrama de influencias. B: como árbol de decisiones (adaptado de Rubio-Terres)13 Mostrar/ocultar
- Estados transitorios: a partir de los cuales el individuo siempre tiene la posibilidad de pasar a un nuevo estado.
- Estados recurrentes: a partir de los cuales el individuo tiene la posibilidad de permanecer en el mismo estado.
- Estados absorbentes: estado facilitador de la terminación del modelo, del que no hay transición posible a otro estado. Después de un número de ciclos, la cohorte entera (o un paciente simulado individualmente) será absorbida por ese estado. En procesos crónicos suele ser la muerte.
Los pacientes transitan de un estado de salud a otro en períodos uniformes de tiempo (que se denominan ciclos de Markov) y con unas probabilidades de transición que dependen del estado de salud en el que se encuentre la persona en cada momento. Durante este proceso se van acumulando los resultados (años de vida ganados, AVACs,…) y los costes para cada una de las intervenciones.
En la práctica podemos diferenciar tres grandes tipos de modelos de Markov, en función de las propiedades respecto al tiempo de las probabilidades de transición:
- Cadenas de Markov: son aquellos que mantienen las probabilidades de transición constantes a lo largo del tiempo que dura el proceso modelizado (patologías con un horizonte temporal corto).
- Procesos de Markov: en ellos las probabilidades de transición varían en el tiempo, es decir, las probabilidades dependen del tiempo y del estado en el que se encuentra el individuo, y no del estado de salud en el periodo anterior (enfermedades crónicas en las que se produce un aumento de la morbi-mortalidad en función de la edad)
- Semiproceso de Markov: en este caso las probabilidades de transición dependen de la duración del tiempo de permanencia en un estado.
Una de las principales limitaciones de los modelos de Markov es que no tienen memoria, es decir, el modelo «olvida» la historia clínica del paciente por lo que la probabilidad de transición en un determinado estado depende únicamente del estado actual del paciente y no tiene en cuenta los estados de salud pasados. Otras limitaciones a este tipo de técnicas son que los períodos de tiempo (ciclos) son prefijados y constantes, que los pacientes sólo pueden estar en un único estado de salud en cada ciclo del modelo y que sólo es posible una única transición por ciclo.
Otros modelos, entre los que caben mencionar los modelos de simulación de eventos discretos (MSED), que se utilizan para estudiar sistemas y procesos cuyo estado va cambiando con el tiempo de forma discreta, por lo que permiten conceptualizar el curso de una enfermedad y su manejo en términos de los eventos que pueden suceder durante la modelización, y cuyo impacto afecta tanto a los pacientes como a otros componentes del sistema (p. ej., el uso de recursos). Las probabilidades de que ocurran cada uno de los eventos se asocian con las características personales de los pacientes14.
También son de especial relevancia los modelos epidemiológicos, empleados por ejemplo en la evaluación económica de medidas profilácticas ante enfermedades infecciosas. Los modelos epidemiológicos dinámicos tienen en cuenta la evolución del proceso en el tiempo, por lo que permiten representar epidemias y captar tanto el efecto directo derivado de la reducción del número de individuos susceptibles como el indirecto asociado a la disminución del número de contactos entre individuos susceptibles e infectivos. La utilización conjunta de modelos dinámicos y arboles de decisión permite combinar el comportamiento epidémico de este tipo de enfermedades con la repercusión en el grado de utilización de los recursos sanitarios, para evaluar con mayor precisión las intervenciones dirigidas a la prevención de enfermedades infecciosas15.
b)Según su naturaleza probabilística
- Modelos determinísticos5: las variables de interés de los estudios (efectos de tratamiento, probabilidades de supervivencia, individuos en cada estado de salud), se introducen y computan directamente a través de fórmulas algebraicas, sin utilizar técnicas de simulación, dado que se suponen no sujetas a incertidumbre.
- Modelos estocásticos5: son modelos probabilísticos que usan la incertidumbre como parte del cálculo, por lo que se emplean técnicas de aleatorización para simular las probabilidades de los eventos que podrían generarse por efecto del azar.
En un análisis probabilístico no todos los pacientes se comportan como el paciente medio, y el modelo refleja explícitamente la variabilidad que pueda haber entre los distintos pacientes dentro de una cohorte. Para ello cada uno de los parámetros del modelo se representa mediante funciones de distribución probabilísticas en lugar de hacerlo mediante estimaciones puntuales, tal como se haría en un análisis determinístico16. Desarrollaremos este tipo de modelización en el siguiente apartado de análisis de la incertidumbre.
Manejo de la incertidumbre en las evaluaciones económicas de intervenciones sanitarias
La incertidumbre es una realidad presente en la EEIS. Esto se debe a que las decisiones se toman con los datos disponibles o accesibles en un momento dado, pero debido a la habitual variabilidad de los datos o a que éstos se determinan a partir de estimaciones muestrales, que pueden no representar fielmente los valores poblacionales, es necesario valorar hasta qué punto dicha incertidumbre afecta a los resultados de un análisis económico17.
El origen de la incertidumbre en una EEIS puede deberse a los siguientes aspectos: a) al método analítico empleado; b) a variaciones muestrales; c) a la validez de los datos disponibles; d) a la generalización de los resultados a la población general, y e) a la posible extrapolación de los resultados intermedios a modificaciones de un resultado final17.
Sea cual sea el origen de la incertidumbre, es necesario que las estimaciones puntuales de coste-efectividad se acompañen de los correspondientes intervalos de incertidumbre que permitan a los agentes decisores apreciar la calidad de la información en la que están basando sus decisiones. Cada causa de incertidumbre aconseja un método diferente para cuantificar su magnitud, principalmente utilizando dos grupos de técnicas: mediante análisis de sensibilidad cualitativos y mediante análisis estadísticos de la incertidumbre17.
a) Análisis de sensibilidad: es una técnica analítica que se utiliza para comprobar el grado de estabilidad de los resultados de la evaluación económica, y hasta qué punto pueden verse éstos afectados cuando se modifican las variables principales o las estimaciones efectuadas. De acuerdo con la totalidad de las directrices publicadas para la realización de EEIS, los resultados del “caso base” siempre deben someterse a un análisis de sensibilidad. En la literatura se habla principalmente de 5 tipos17,18:
- AS univariante: consiste en modificar el valor de un único parámetro, dentro de un rango predefinido y justificado, manteniendo el resto constantes y observar cómo cambian los resultados. Permite identificar los parámetros que resultan más influyentes en los resultados finales. Pese a ser el más usado, este tipo de análisis no es teóricamente el más correcto. La razón principal estriba en que en la realidad los parámetros no son independientes, o incluso aunque lo sean, parece difícil suponer que cuando varía el valor de un parámetro, todos los demás siguen igual.
- AS multivariante: consiste en modificar varios parámetros a la vez. En este caso su mayor limitación radica en que cuantas más variables se modifican al mismo tiempo, más complicada resulta la interpretación de los resultados de este tipo de análisis.
- AS de extremos: en el que se estudia el escenario más optimista (mejor) y el más pesimista (peor) para la intervención sanitaria que se está evaluando. Si la intervención es coste-efectiva incluso en tales escenarios extremos podemos tener una gran seguridad en los resultados de la evaluación. Sin embargo, es una situación poco frecuente y realista.
- AS umbral: identifica el valor crítico (punto de corte) de un parámetro, por encima o por debajo del cual las conclusiones de la evaluación cambian. Esta técnica es especialmente útil cuando se trata de establecer el valor de un parámetro indeterminado, como el precio de un medicamento antes de su comercialización.
- AS probabilístico: estas limitaciones del análisis de sensibilidad que hemos ido comentado puede solucionarse mediante los métodos probabilísticos, que asumen que la incertidumbre presente en cada uno de los parámetros sigue una distribución estadística específica y, mediante simulaciones de Monte Carlo, permiten modificar todos los parámetros al mismo tiempo y generar intervalos de confianza sobre las ratios coste-efectividad.
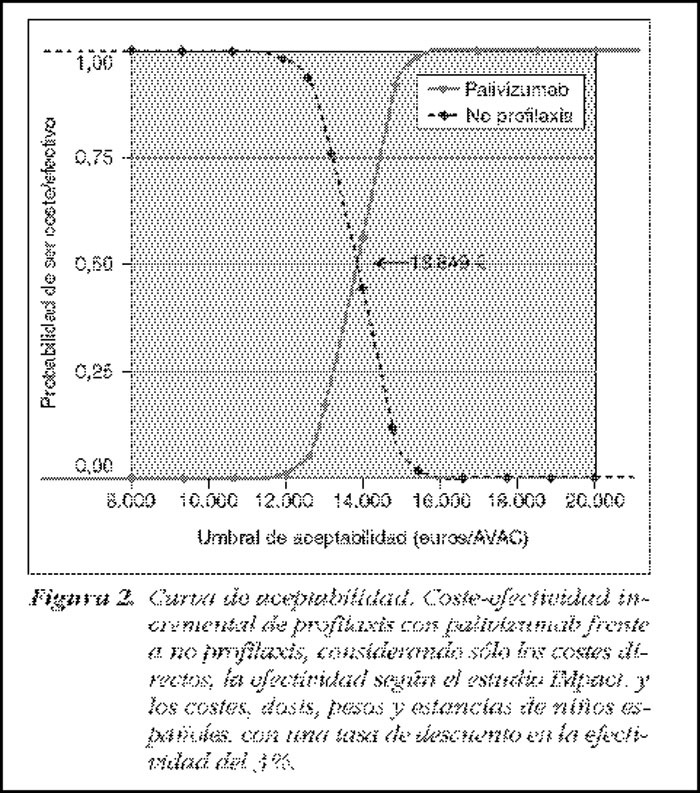
La simulación repetida del modelo extrayendo cada vez un grupo distinto de valores de las funciones de distribución de los parámetros sujetos a incertidumbre, permite obtener distribuciones conjuntas de costes y efectos, que en el plano coste-efectividad queda representado por una nube de puntos. Dichos diagramas de dispersión incluyen tanto la estimación determinística que obtendríamos al representar cada uno de los parámetros del modelo mediante estimaciones puntuales, como el coste incremental y la efectividad incremental de cada simulación. La pendiente de la línea recta que une cualquier punto de la nube de puntos con el origen de coordenadas representa la razón coste-efectividad incremental de esa simulación específica. Esta misma información puede trasladarse a una curva de aceptabilidad, que representa la probabilidad de que una intervención sanitaria sea coste-efectiva para distintos valores de un cociente coste-efectividad incremental máximo considerado aceptable por los decisores. En el eje horizontal tenemos el valor máximo que el decisor está dispuesto a pagar por cada unidad de resultado (por ejemplo, AVAC) y en el eje vertical el porcentaje de simulaciones o puntos de la nube que caen por debajo de ese umbral16. Así, si tomamos como ejemplo la curva de aceptabilidad publicada por Lázaro y De Mercado19, si el decisor está dispuesto a pagar aproximadamente 15 000 € por AVAC ganado, existe un 90% de probabilidad de que la intervención sea coste-efectiva (es decir, el coste-efectividad incremental -CEI- del 90% de las simulaciones se encuentran por debajo de los 15 000 € por AVAC ganado). El punto del 50% se corresponde a la estimación puntual de coste-efectividad, 13 849 € por AVAC (Figura 3).
Figura 3. Interpretación de una curva de aceptabilidad (figura de Lázaro y De Mercado)19 Mostrar/ocultar
b) Análisis estadísticos de la incertidumbre: con el objetivo de determinar el intervalo de confianza de la razón CEI se utilizan diversos métodos paramétricos (como los cuasi-intervalos de confianza, la expansión de series de Taylor, las elipses de confianza o el método de Fieller) o los métodos de muestreo repetitivo no paramétricos17,18.
El muestreo repetitivo o bootstrapping consiste en estudiar empíricamente el comportamiento de la razón CEI a lo largo de un elevado número de submuestras obtenidas mediante la eliminación de casos al azar. Este método no impone ninguna asunción sobre la distribución de los parámetros y tiene en cuenta el sesgo o desviación de los resultados; por ello, resulta especialmente útil cuando las distribuciones entorno a un parámetro determinado son asimétricas, es decir, cuando están desviadas o sesgadas, o cuando el tamaño de la muestra no es grande. Los resultados también pueden representarse gráficamente en el plano coste-efectividad y obtener una curva de aceptabilidad.
Criterios de toma de decisiones en evaluación económica
El objetivo fundamental de cualquier sistema sanitario es maximizar el nivel de salud de la población a la que da cobertura. Pero los recursos económicos disponibles para tal fin son limitados y no suelen ser suficientes para cubrir todas las necesidades que en este ámbito se presentan. Por esta razón, los agentes que toman las decisiones deben establecer qué acciones resultan prioritarias para poder maximizar el beneficio producido con los recursos disponibles. En el pasado, los análisis de costes se habían limitado a comparar precios unitarios de los nuevos productos en relación a los antiguos. Sin embargo, en la actualidad los análisis deben ir más allá de la simple comparación aislada de costes, y considerar estos últimos en función de los resultados obtenidos por las distintas opciones existentes. Por esa razón, cada vez es más frecuente que las decisiones relacionadas con los nuevos medicamentos (fijación de precio, financiación pública, incorporación a los formularios de hospital, inclusión en guías de práctica clínica) se realicen no solo en base a criterios de eficacia, seguridad y calidad, sino también, considerando su perfil de coste-efectividad. En la práctica, se pueden tener en cuenta básicamente 2 criterios para tomar decisiones: el presupuesto y el precio por unidad de efectividad adicional20.
Con el presupuesto como criterio para tomar decisiones, éstas dependerán del tamaño de aquél para pagar las opciones en cuestión. El objetivo del decisor será escoger la intervención o intervenciones que maximicen los beneficios sin exceder el presupuesto establecido.
En lugar de utilizar el presupuesto como criterio para la decisión, se puede determinar cuál es el precio máximo que se está dispuesto a pagar por una unidad de efectividad. El objetivo del decisor es en este caso escoger la intervención más efectiva para la cual el coste incremental por unidad de efectividad ganada es inferior al precio máximo que se quiere pagar20,21. Esto significa determinar un límite de eficiencia que establezca si una intervención tiene una relación coste-efectividad aceptable. Si revisamos la bibliografía internacional y las decisiones de los últimos años de organismos como el National Institute for Clinical Excellence (NICE) en Reino Unido, el Pharmaceutical Benefits Advasory Comittee (PBAC) en Australia, o el Canadian Agency for Drugs and Technologies in Health (CADTH) en Canadá, podemos determinar cuál es el precio máximo que estos países están dispuestos a pagar por unidad de efectividad. Un reciente análisis basado en las decisiones realizadas por el NICE hasta mayo de 2002, sugiere que el límite implícitamente establecido es algo superior al umbral públicamente identificado de 20 000-30 000 £ por AVAC22. Esto queda reflejado en su guía metodológica de evaluación económica que acepta como coste-efectivas aquellas intervenciones con un cociente CEI inferior a 20 000 £/AVAC. Sin embargo, deben existir importantes motivos relacionados con la innovación, el grado de incertidumbre de los resultados o la validez de la evaluación de la calidad de vida, para considerar eficientes las intervenciones con un CEI superior a 30 000 £/AVAC23. En Australia, el mayor coste por AVAC de un tratamiento recomendado por el PBAC entre los años 1994 y 2003 fue de 52 400 $24. En EEUU se considera que una intervención sanitaria presenta una relación coste-efectividad aceptable si el coste adicional de cada AVAC ganado es inferior a los 50,000 $ e inaceptable cuando supera los 100 000 $, si bien esta práctica carece de soporte teórico y de la opinión de expertos25. En Canadá se ha estimado que el rango de este valor umbral se sitúa entre 20 000 y 100 000 $ por AVAC26.
En España no existe un criterio unánime a la hora de realizar tales recomendaciones, es decir, no hay un criterio sobre lo que es una intervención sanitaria eficiente. En una revisión de la bibliografía realizada por Sacristán y cols. se ha planteado que todas las intervenciones hasta 30 000 €/AVG serían eficientes, e ineficientes las superiores a 120 000 €/AVG. Entre 30 000 y 120 000 € por AVG habría una zona de incertidumbre sobre la cual sería difícil pronunciarse27.
Pero para adoptar una u otra opción, no es suficiente con los cálculos realizados en una evaluación económica. Aunque la utilización de criterios sencillos y objetivos (como la aplicación de un límite de eficiencia establecido a priori) siempre resulta atractiva, en la práctica hay otros criterios, aparte del de eficiencia, que los decisores no pueden obviar. Si nos fijamos en las experiencias de estos mismos países, veremos que ninguno de ellos considera la eficiencia como único criterio de decisión. A menudo se tienen en cuenta factores como la existencia o no de opciones terapéuticas, le relevancia social de la enfermedad, el número de pacientes afectados y fundamentalmente el criterio de equidad, según el cual sería preferible proporcionar una intervención menos eficiente a toda la población que una intervención más eficiente a sólo una parte. El criterio de eficiencia es sólo una herramienta para ayudar en las decisiones sobre priorización21,28. En línea con esta idea, recientemente el NICE ha puesto en marcha una nueva iniciativa para aumentar su límite de 20 000-30 000 £/AVAC en el caso de tratamientos de enfermedades para las que la esperanza de vida sea menor a 2 años, siempre y cuando cumplan una serie de requisitos: el tratamiento debe estar indicado para pacientes con una corta esperanza de vida (normalmente menor a 24 meses), debe prolongar la vida en al menos tres meses adicionales, no debe existir otro alternativa disponible y el tratamiento debe estar indicado para una pequeña población de pacientes29,30. En la práctica, hace referencia a los productos oncológicos y plantea la posibilidad de asignar un mayor valor a los AVACs ganados en últimas etapas de enfermedades terminales. Estas directrices han sido elaboradas teniendo en cuenta la opinión de la sociedad, y constituyen un avance en la evaluación de intervenciones sanitarias, haciendo más transparente el proceso de toma de decisiones.
Análisis de la metodología y manejo de la incertidumbre en las evaluaciones económicas de intervenciones sanitarias realizadas en población pediátrica en España
Con el objetivo de identificar los artículos de EEIS realizadas en población pediátrica en España publicadas en los últimos 15 años se realizó una búsqueda bibliográfica en cuatro bases de datos, desde el año 1994 hasta octubre de 2009: MedLine (National Library of Medicine), EMBASE (Elsevier), IBECS-Índice Bibliográfico Español en Ciencias de la Salud (BNCS, Instituto Carlos III) y MEDES-Medicina en español (Fundación Lilly). En la estrategia de búsqueda utilizada en MedLine y EMBASE, se incluyeron términos generales de economía de la salud y referidos a tipos de evaluación económica. Para limitar el ámbito geográfico, la búsqueda seleccionó publicaciones en las que aparecieran términos referidos a España o cualquiera de las comunidades autónomas o capitales de provincia españolas. Los estudios realizados en población pediátrica fueron seleccionados a través de los descriptores de limitación de edad (recién nacidos, niños, adolescentes). En el resto de bases de datos las búsquedas se realizaron utilizando las principales palabras clave en los campos de titulo o descriptor. Del total de los artículos encontrados, se seleccionaron las evaluaciones económicas completas, es decir aquellas que evaluaban al menos dos tecnologías alternativas (pudiendo ser una de ellas la opción de “no hacer nada”), midiendo tanto los costes como los efectos resultantes de su aplicación. En el siguiente artículo de esta serie, los autores se centrarán en realizar una revisión de estas EEIS desde la perspectiva de las principales guías o directrices de evaluación económica publicadas por las más importantes agencias evaluadoras. Sin embargo, dado el contenido del presente artículo, hemos querido avanzar un análisis de la metodología y manejo de la incertidumbre realizados (Tabla 2).
Tabla 2. Evaluaciones económicas en población pediátrica publicadas por autores españoles y de ámbito español. Mostrar/ocultar
Se localizaron un total de 30 artículos siendo la mayoría de ellos evaluaciones económicas de intervenciones profilácticas, y en concreto, vacunas: vacuna del virus de la gripe (2), vacuna del rotavirus (1), vacuna del virus del papiloma humano (2), vacuna del virus Varicella Zoster (5), vacuna antineumocócica heptavalente (2), vacuna antineumocócica (2), vacuna de Haemophilus Influenzae tipo B (1), vacuna de la hepatitis B (4), vacuna de la hepatitis A (1). Dada la importancia que tiene proteger a los niños de enfermedades propiamente “infantiles”, además de evitar futuras enfermedades cuando sean adultos, es razonable esperar que en Pediatría un mayor volumen de literatura económica este dedicada al estudio de la eficiencia de estas intervenciones preventivas. Otra posible explicación es la propia necesidad de que se lleven a cabo estos estudios: por un lado, son medidas aplicadas sobre la población pediátrica general o subgrupos de riesgo de elevado tamaño y, por otro, su coste se ha ido incrementado en los últimos años, por lo que las administraciones sanitarias requieren evaluar su rentabilidad económica para tomar una decisión sobre su utilización31. Este se vería reforzado por el hecho de que la perspectiva mayoritariamente utilizada en estos análisis es la del sistema nacional de salud o el de la consejería de la comunidad autónoma correspondiente, responsables de la decisión de incorporar nuevas vacunas al calendario vacunal infanto-juvenil.
Dentro de las medidas de prevención, cabe resaltar también los estudios realizados con palivizumab, anticuerpo monoclonal específico indicado en la prevención de infecciones del tracto respiratorio causadas por el virus sincitial respiratorio (VSR). La epidemiología de la enfermedad (el VSR es primera causa de bronquiolitis en niños menores de dos años), la eficacia de la profilaxis y el elevado coste de administración de una anticuerpo monoclonal explicarían los 3 estudios de evaluación económica realizados en nuestro país, cuyos resultados avalan el uso de palivizumab en los subgrupos de mayor riesgo especificados por la Sociedad Española de Neonatología32.
El tipo de análisis económico más utilizado fue el coste-efectividad, seguido del coste-beneficio y del coste-utilidad, realizándose más de un tipo de evaluación en 6 publicaciones. Respecto a la metodología, el 70% de los estudios utilizaron técnicas de modelización, principalmente arboles de decisión, con el objetivo de extrapolar los resultados más allá de la duración de los ensayos clínicos existentes o a la población diana de la estrategia terapéutica en estudio. Sin embargo, aun siendo las vacunas las intervenciones sanitarias mas evaluadas, muy pocos estudios utilizaron modelos epidemiológicos para predecir con mayor exactitud el efecto de la vacunación sobre la población33. El 80% de los estudios realizaron análisis de sensibilidad para comprobar la robustez de los resultados, aunque los análisis probabilísticos tuvieron una escasa presencia.
Aunque el volumen de evaluaciones económicas en población pediátrica publicadas en nuestro país continúa situándose por debajo de las de población adulta, la tendencia en los últimos años refleja un aumento de la importancia de este tipo de análisis, habiéndose doblado el número de publicaciones en la última década. Cabe esperar que este número siga aumentando, dado la mayor incorporación de la evaluación económica en la toma de decisiones a diferentes niveles (macro, meso, micro) con el objetivo de asegurar un uso racional de los recursos sanitarios. Además la creciente utilización de fármacos biotecnológicos en Pediatría, cuyos costes asociados de investigación, desarrollo y fabricación suelen actuar de barrera a la hora de su introducción en los sistemas sanitarios, va a hacer especialmente relevante demostrar su valor clínico y económico.Cómo citar este artículo
Valladares A, González de Dios J, Sacristán JA. Evaluación Económica en Medicina (II): Métodos de evaluación económica y manejo de la incertidumbre asociada. Evid Pediatr. 2009;5:88.
Bibliografía
- Dilla T, González de Dios J, Sacristán JA. Evaluación Económica en Medicina (I): Fundamentos y Metodología. Evid Pediatr. 2009;5:71.
- Sacristán del Castillo JA, Badía X, Rovira J. Farmacoeconomía: evaluación económica de medicamentos. Madrid: Editores Médicos,1995.
- Rubio-Terrés C, Sacristán JA, Badia X, Cobo E, García Alonso F; Grupo ECOMED. Métodos utilizados para realizar evaluaciones económicas de intervenciones sanitarias. Med Clin (Barc). 2004;122:578-83.
- Jiménez FJ, Marazuela R. Estudios de farmacoeconomía empleando diseños observacionales. En: Domínguez-Gil Hurlé A, Soto Álvarez J (Coord). Farmacoeconomía e investigación de resultados en la salud: Principios y práctica. Situación actual y perspectivas futuras en España. Madrid: Real Academia de Farmacia, 2002:321-35.
- Rodríguez Barrios JM. Papel de los modelos en las evaluaciones económicas en el campo sanitario. Farm Hosp. 2004;28:231-42.
- Stahl JE. Modelling methods for pharmacoeconomics and health technology assessment: an overview and guide. Pharmacoeconomics. 2008;26:131-48.
- Weinstein MC, eds. Cost-effectiveness in health and medicine, pp 135-175. Oxford University Press, 1996.
- López Bastida J, Oliva J, Antoñanzas F García-Altés A, Gisbert R, Mar J, et al. Propuesta de guía para la evaluación económica aplicada a las tecnologías sanitarias. Madrid: Plan Nacional para el SNS del MSC. Servicio de Evaluación del Servicio Canario de la Salud; 2008. Informes de Evaluación de Tecnologías Sanitarias: SESCS Nº 2006/22.
- Brosa M. La utilidad de la modelización clínico-económica en la investigación de resultados en salud. En: Badia X, ed. La investigación de resultados en salud. Barcelona: Edimac, 2000:232-233.
- Brennan A, Chick SE, Davies R. A taxonomy of model structures for economic evaluation of health technologies. Health Econ. 2006;15:1295-310.
- Rubio S. Estudios de farmacoeconomía a través de modelos basados en análisis de decisión. en: Domínguez-Gil Hurlé A, Soto Álvarez J (Coord). Farmacoeconomía e investigación de resultados en la salud: Principios y práctica. Situación actual y perspectivas futuras en España. Madrid: Real Academia de Farmacia, 2002:261-80.
- Darbà J. Los modelos de decisiones en la evaluación económica de tecnologías sanitarias: Calidad y buenas prácticas metodológicas. Pharmacoeconomics - Spanish Research Articles. 2006;3:31-8.
- Rubio-Terrés C, Echevarría A. La herramienta clave: modelos de Markov. Pharmacoeconomics - Spanish Research Articles. 2006;3(Supl. 2):71-8.
- Rodríguez Barrios JM, Serrano D, Monleón T, Caro J. Los modelos de simulación de eventos discretos en la evaluación económica de tecnologías y productos sanitarios. Gac Sanit. 2008;22:151-61.
- Pradas Velasco R, Antoñanzas Villar F, Mar J. Modelos matemáticos para la evaluación económica: los modelos dinámicos basados en ecuaciones diferenciales. Gac Sanit. 2009;23:473–8.
- Darbà J. La utilización de métodos probabilísticos para la evaluación económica de tecnologías sanitarias. Gac Sanit 2006;20:74-9.
- Rubio-Terrés C, Cobo E, Sacristán JA, Prieto L, del Llano J, Badia X; Grupo ECOMED. Análisis de la incertidumbre en las evaluaciones económicas de intervenciones sanitarias. Med Clin (Barc). 2004;122:668-74.
- Pinto Prades JL, Sánchez Martínez FI. Métodos para la evaluación económica de nuevas prestaciones. Ministerio de Sanidad y Consumo,2003.
- Lázaro y De Mercado P, Figueras J, Domenech E, Echaniz I, Closa R, Wood MA, et al. La eficiencia (coste-efectividad) de palivizumab como profilaxis para la infección por virus respiratorio sincitial en prematuros de 32-35 semanas en España. An Pediatr (Barc). 2006;65:316-24.
- Prieto L, Sacristán JA, Antoñanzas F, Rubio-Terrés C, Pinto JL, Rovira J; Grupo ECOMED. Análisis coste-efectividad en la evaluación económica de intervenciones sanitarias. Med Clín (Barc). 2004;122:505-10.
- Sacristán JA, Rovira J, Ortún V, García-Alonso F, Prieto L, Antoñanzas F; Grupo ECOMED. Utilización de las evaluaciones económicas de intervenciones sanitarias. Med Clin (Barc). 2004;122:789-95.
- Devlin N, Parkin D. Does NICE have a cost-effectiveness threshold and what other factors influence its decisions? A binary choice analysis. Health Econ. 2004; 13:437–52.
- National Institute for Health and Clinical Excellence. Guide to the methods of technology appraisal. Londres, NICE,2008.
- Henry DA, Hill SR, Harris A. Drug prices and value for money: the Australian Pharmaceutical Benefits Scheme. JAMA. 2005;294:2630-2.
- Grosse SD, Teutsch SM, Haddix AC. Lessons from cost-effectiveness research for United States public health policy. Annu Rev Public Health. 2007;28:365-91.
- Laupacis A, Feeny D, Detsky AS, Tugwell PX. How attractive does a new technology have to be to warrant adoption and utilization? Tentative guidelines for using clinical and economic evaluations. CMAJ. 1992;146:473–81.
- Sacristán JA, Oliva J, Del Llano J, Prieto L, Pinto JL. ¿Qué es una tecnología sanitaria eficiente en España? Gac Sanit. 2002;16:334-43.
- Sacristán JA, Dilla T, Antoñanzas F, Pinto JL. Evaluación económica de medicamentos: experiencias y vías de avance. Gac Sanit. 2008;22:354-57.
- National Institute for Health and Clinical Excellence. Appraising life-extending, end of life treatments. Londres, NICE,2008.
- Raftery J. NICE and the challenge of cancer drugs. BMJ. 2009;338: b67.
- Saucedo JL, Clemente S, Mendarte L, Montoro JB. Eficiencia de los fármacos de origen biotecnológico en el marco terapéutico actual, según los estudios farmacoeconómicos disponibles. Pharmacoeconomics - Spanish Research Articles. 2008;5:119-33.
- González de Dios J, Ochoa Sangrador C. Farmacos biotecnologicos, farmacoeconomia y asistencia sanitaria basada en pruebas. An Pediatr (Barc). 2004;60):207-11.
- Drummond M, Chevat C, Lothgren M. Do we fully understand the economic value of vaccines? Vaccine. 2007;25:5945-57.
- Salleras L, Navas E, Dominguez A, Ibañez D, Prat A, Garrido P et al. Economic benefits for the family of inactivated subunit virosomal influenza vaccination of healthy children aged 3-14 years during theannual health examination in private paediatric offices. Vaccine. 2009;27:3454-8.
- Hormigo J, García-Altés A, López MJ, Bartoll X, Nebot M, Ariza C. Análisis de coste-beneficio de un programa de prevención del tabaquismo en escolares. Gac Sanit. 2009;23:311–4.
- Hong J, Dilla T, Arellano J. A modelled economic evaluation comparing atomoxetine with methylphenidate in the treatment of children withattention-deficit/hyperactivity disorder in Spain. BMC Psychiatry. 2009;9(15).
- Serrano MC, Pérez I, Rodríguez R, Expósito JC, González JA, Álvarez MM. Situación epidemiológica de infección por rotavirus en Extremadura (2003-2006). Eficiencia de la vacunación sistemática frente a la infección por rotavirus. Vacunas. 2008;9:151-5.
- Largeron N, Rémy V, Oyee J, San-Martín M, Cortés J, Olmos L. Análisis de coste-efectividad de la vacunación frente al virus del papiloma humano tipos 6, 11, 16 y 18 en España. Vacunas. 2008;9:3-11.
- Perez-Rubio A, Castrodeza J, Gil M, Luquero F, Eiros J, Ortiz de Lejazaru R. Impacto social y económico de la vacunación frente a la varicela a los 15 meses de edad en Castilla y León en 2008. Rev Esp Salud Publica. 2008;82:101-9.
- Lázaro y De Mercado P, Figueras J, Domenech E, Closa R, Echaniz I, Wood MA, et al. Coste-efectividad de palivizumab para prevenir el virus respiratorio sincitial en niños prematuros y niños con enfermedad pulmonar crónica en España. Pharmacoeconomics. 2007;4:59-70.
- Navas E, Salleras L, Domínguez A, Ibáñez D, Prat A, Sentís J, et al. Cost-effectiveness analysis of inactivated virosomal subunit influenza vaccination in children aged 3-14 years from the provider and societal perspectives. Vaccine. 2007;25:3233-9.
- López Alemany JM, Cortés Bordoy, J. Gil de Miguel Á. Estudio de coste-efectividad de la vacuna tetravalente del papilomavirus humano. Rev Esp Econ Salud. 2007;6:400-8.
- Lenne X, Díez-Domingo J, Gil A, Ridao M, Lluch JA, Dervaux B. Economic evaluation of varicella vaccination in Spain—Results from a dynamic model. Vaccine. 2006;24:6980-9.
- Navas E, Salleras L, Gisbert R, Dominguez A, Timoner E, Ibañez D, et al. Cost-benefit and cost-effectiveness of the incorporation of the pneumococcal 7-valent conjugated vaccine in the routine vaccination schedule of Catalonia (Spain). Vaccine. 2005;23:2342-8.
- Asensi F, De Jose M, Lorente M, Moraga F, Ciuryla V, Arikian S, et al. A pharmacoeconomic evaluation of seven-valent pneumococcal conjugate vaccine in Spain. Value Health. 2004;7:36-51.
- Peña-Rey I, Pérez-Farinós N, Cortés-García M, Amela-Heras C. Coste-efectividad de la vacunación contra la varicela en adolescentes en España. Gac Sanit. 2004;18:287-94.
- Reinoso F, Duran P, García-Fernández J, Saavedra B, De Vicente J, Lahoz AI, et al. Análisis coste/efectividad de tres técnicas de analgesia epidural en el tratamiento del dolor postoperatorio pediátrico. Rev Soc Esp Dolor. 2003;10:469-74.
- Plaza G, De Los Santos G. Análisis de coste-efectividad del tratamiento de la otitis media serosa infantil. Acta Otorrinolaringol Esp. 2003;54:316-24.
- Lapeña S, Robles MB, Martínez JP, Castañon L, Mallo J, Herrero B, et al. Impacto potencial y análisis coste-eficacia de la profilaxis con palivizumab, en la prevención de bronquiolitis, en prematuros menores de 33 semanas de gestación. An Pediatr (Barc). 2003;59:328-33.
- Plans P. Coste-efectividad de la vacunación antineumocócica 23-valente en Cataluña. Gac Sanit. 2002;16:392-400.
- Madero L, González-Vicent M, Ramírez M, Quintero V, Benito A, Díaz MA. Clinical and economic comparison of allogeneic peripheral blood progenitor cell and bone marrow transplantation for acute lymphoblastic leukemia in children. Bone Marrow Transplant. 2000;26:269-73.
- Forcén T, Garuz R, Cabasés J, Ruíz de Ocenda M, Martínez JA, Izco J. Evaluación económica de la vacunación rutinaria a niños de 15 meses de edad frente al virus de la varicela-zoster. An Sist Sanit Navar. 2000;23:115-24.
- Tejedor I, Idoate A, Jiménez M, Sierrasesumaga L, Giráldez J. Cost-effectiveness analysis of tropisetron vs. chlorpromazine-dexamethasone in the control of acute emesis induced by highly emetogenic chemotherapy in children. Pharm World Sci. 1999;21:60-8.
- Díez Domingo J, Ridao M, Latour J, Ballester A, Morant A. A cost benefit analysis of routine varicella vaccination in Spain. Vaccine. 1999;17:1306-11.
- Lugo RA, Chester EA, Cash J, Grant MJC, Vernon DD. A cost analysis of enterally administered lorazepam in the pediatric intensive care unit. Crit Care Med. 1999;27:417-21.
- Jiménez FJ, Guallar-Castillón P, Rubio C, Guallar E. Cost-Benefit Analysis of Haemophilus influenzae Type b Vaccination in Children in Spain. Pharmacoeconomics. 1999;15:75-83.
- Garuz R, Torrea JL, Arnal JM, Forcén T, Trinxet C, Antón F, et al. Vaccination against hepatitis B virus in Spain: a cost-effectiveness analysis. Vaccine. 1997;15:1652-60.
- Arnal JM, Frisas O, Garuz R, Antoñanzas F. Cost effectiveness od hepatitis A virus inmunisation in Spain. Pharmacoeconomics. 1997;12:361-73.
- Antoñanzas F, Garuz R, Rovira J, Antón F, Trinxet C, Navas E, et al. Cost-effectiveness analysis of hepatitis B vaccination strategies in Catalonia, Spain. Pharmacoeconomics 1995;7:428-43.
- Guillén F, Espín MI. Análisis coste-efectividad de las distintas alternativas de vacunación universal frente a la hepatitis B en la región de Murcia. Med Clin (Barc). 1995;104:130-6.
- Plans Rubió P, Garrido Morales P, Salleras Sanmartí L. Coste efectividad de la vacunación neumocócica en Cataluña. Rev Esp Salud Publica. 1995;69:409-17.
- Garuz R, Arnal JM, Forcén T. Trinxet C, Antoñanzas F. Análisis coste-efectividad de la prevención prenatal frente al virus de la hepatitis B. An Esp Pediatr. 1994;40:405-10.


Envío de comentarios a los autores