Toma de decisiones clínicas basadas en pruebas científicas
EVIDENCIAS EN PEDIATRÍA
Diciembre 2015. Volumen 11. Número 4
| ¿Es útil la calprotectina fecal para el diagnóstico de la enfermedad inflamatoria intestinal crónica del niño?
Valoración: 0 (0 Votos)Autores: Ortega Páez E, Pérez-Moneo Agapito B.
 Suscripción gratuita al boletín de novedades
Suscripción gratuita al boletín de novedades
Reciba periódicamente por correo electrónico los últimos artículos publicados
Suscribirse |
Autores:
Correspondencia:
Escenario Clínico
Los padres de Manuel, un niño de 12 años, consultan en el centro de salud para comentarle que ha estado ingresado hace un mes por una gastroenteritis aguda enteroinvasiva que ya se le ha pasado. Notan que desde entonces hace alguna deposición blanda o casi líquida, pero de forma intermitente, con dolor abdominal en mesohipogastrio que se alivia tras la deposición, y además creen que ha crecido poco últimamente. Están preocupados por ello. Preguntan si hubiera alguna prueba que pudiera descartar la presencia de una enfermedad inflamatoria intestinal, ya que una amiga de la madre tiene colitis ulcerosa y dice que empezó igual.
Usted les explica que, con lo que cuentan, es poco probable que tenga una enfermedad inflamatoria intestinal, que seguro que las deposiciones se normalizan en unas semanas. No obstante, conoce la existencia de una prueba denominada calprotectina fecal, que les podría sacar de dudas y les plantea su realización.
Para poder informar correctamente, se plantea la siguiente pregunta clínica:
Pregunta Clínica
¿En niños con sospecha de enfermedad inflamatoria intestinal [paciente], la realización de calprotectina fecal [intervención] (no) [comparación], es útil para su diagnóstico [outcome o resultado]?
Búsqueda Bibliográfica
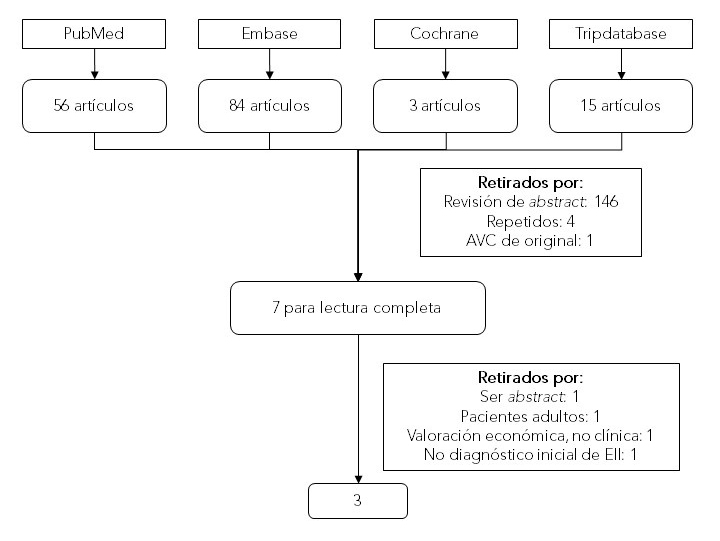
Se realizó una búsqueda por dos revisores independientes en las siguientes bases de datos: MEDLINE, Trip Database, Embase y Cochrane Central Register of Controlled Trials (CENTRAL) (Tabla 1 y Figura 1).
- Criterios de selección: trabajos sobre revisiones sistemáticas (RS) y metanálisis(MA) sobre el uso de calprotectina para diagnóstico inicial de enfermedad inflamatoria intestinal (EII) en edad pediátrica.
- Criterios de exclusión: RS y MA realizados en adultos.
Tras la lectura de título y resumen por ambos revisores, se escogen siete para su lectura completa (Figura 1). Finalmente quedaron tres artículos; entre ambos autores se extrajeron los datos y se evaluó tanto su calidad metodológica como la precisión diagnóstica (Tabla 2).
Figura 1. Diagrama de flujo de la selección de estudios Mostrar/ocultar
Tabla 1. Descriptores utilizados para la búsqueda Mostrar/ocultar
Tabla 2. Tipos de estudios elegidos y su valoración Mostrar/ocultar
Comentario
La enfermedad inflamatoria intestinal, en sus dos formas clásicas, enfermedad de Crohn (EC) y colitis ulcerosa (CU), cobra cada día más importancia en la edad pediátrica. Se ha comunicado un aumento de más del 50% en los últimos años, siendo la incidencia en su conjunto del 2,8%1. La presentación clínica no es patognomónica y se puede solapar en el niño más a menudo que en el adulto, lo que puede llevar a retrasos en el diagnóstico2 y por consiguiente empeorar su pronóstico. Aunque el diagnóstico definitivo se realiza mediante confirmación endoscópica e histológica es importante contar con pruebas diagnósticas, ya que los marcadores clásicos de inflamación intestinal pueden no ser discriminativos en etapas precoces de la enfermedad3. La calprotectina fecal (CF), una proteína pequeña (36KD) presente en el citoplasma de los leucocitos neutrófilos y que se excreta a la luz intestinal en presencia de rotura de los mismos, donde queda inalterada durante siete días, cumple los requisitos de un marcador subrrogado de inflamación intestinal y podría ser un buen marcador precoz de la enfermedad.
Sobre la utilidad de la CF en el diagnóstico de la EII se seleccionaron tres RS4-6, cuya valoración se encuentra resumida en la Tabla 2.
La RS de Degraeuwe et al. es la más reciente, analiza estudios de cohortes con metanálisis de datos agrupados (MAG) como se realiza habitualmente y metodológicamente es correcta. La debilidad más importante es una alta heterogeneidad no explicada intraestudios e interestudios, que podría explicarse por las diferencias de edades en la selección de los sujetos, diferencias de prevalencias de la EII (del 51% al 85%) y por diferentes puntos de corte para la CF; esto hace que, aunque el análisis combinado de datos es el adecuado, no garantice su conveniencia. El metanálisisde pacientes individuales (MAPI) no añade nada nuevo en cuanto a medidas de impacto, pero aporta un modelo probabilístico predictivo según la edad del paciente que debería ser validado.
Tomando de referencia el MAPI, valores mayores de 212 g/g de CF y un escenario de alta prevalencia de EII (54%), como podría ser en el ámbito hospitalario, aumentaría la probabilidad de EII hasta un 86,7% y con valores menores disminuiría al 12%, evidenciando su utilidad para seleccionar a los pacientes susceptibles de realizar endoscopia de confirmación. En escenarios con baja prevalencia como sería en Atención Primaria (0,4%)7, valores altos de CF no serían discriminativos de EII y valores más bajos prácticamente lo descartan.
La segunda RS de Henderson et al.5 está basada en una combinación de estudios de casos y controles. Aunque se contactó personalmente con los autores de los artículos individuales, no se puede descartar cierto sesgo a la hora de incluir los pacientes, como son la exclusión en algunos de los estudios de pacientes menores de seis años, la ausencia de casos de colitis indeterminada, la heterogeneidad de la prevalencia de EII (del 28 al 77%), que, junto con no haberse podido determinar un punto de corte óptimo, podrían disminuir la representatividad de la muestra. El empleo de puntos de corte más bajos que el anterior estudio de Degraeuwe hace que se obtengan valores de sensibilidad más altos y más bajos de especificidad, pero con cocientes de probabilidad muy parecidos, con un comportamiento muy semejante, aunque algo menor en el aumento de sospecha de EII (79%) en el medio hospitalario.
El último estudio comentado,de Van Rheenen et al.6, metodológicamente correcto, tiene menor tamaño muestral (371) que los anteriores y presenta una evaluación como subgrupo junto con adultos. El punto de corte es muy similar al de Henderson, pero con una mayor prevalencia de EII en los pacientes incluidos, lo que podría conllevar a una mala representatividad de la muestra. Se encontró significativamente menor especificidad en los niños frente a los adultos en la determinación de CF, a la vez que una mayor prevalencia; esto hace que el resultado negativo tenga más valor en los adultos que en los niños con Ppos (-) 3% y 15% respectivamente.
Resolución del Escenario
A la luz de los resultados, les explica a los padres que, aunque es muy poco probable la presencia de una EII con los síntomas que tiene su hijo, existe una prueba en heces llamada CF, que es incruenta, fácil, rápida y útil para decidir la actitud posterior. En Atención Primaria, donde la probabilidad preprueba en general es muy baja, el test tendría utilidad si obtenemos resultados por debajo de 50-100 mcg/g. Esto prácticamente nos permitiría descartar la enfermedad y evitar derivaciones innecesarias a Atención Especializada. En escenarios clínicos de alta prevalencia, como es el medio hospitalario, puntos de corte por encima de 200 mcg/g aumentarían sustancialmente la sospecha de EII (probabilidades postest positivas altas) seleccionando a estos pacientes para confirmación endoscópica. En ambos escenarios, la prueba parece útil, ya que por cada por cada 13-15 determinaciones que realizamos, diez serían válidas (número necesario a diagnosticar [NND]). No obstante, todavía habría que comprobar el rendimiento de la prueba en escenarios de bajo riesgo, ya que las estimaciones realizadas se han hecho a partir de los datos de muestras de pacientes con alto riesgo de EII.
Cómo citar este artículo
Ortega Páez E, Pérez Moneo-Agapito B. ¿Es útil la calprotectina fecal para el diagnóstico de la enfermedad inflamatoria intestinal crónica del niño? Evid Pediatr. 2015;11:55.
Bibliografía
- Martín-de-Carpi J, Rodríguez A, Ramos E, Jiménez S, Martínez-Gómez MJ, Medina E, et al. Increasing incidence of pediatric inflammatory bowel disease in Spain (1996-2009): the SPIRIT Registry. Inflamm Bowel Dis. 2013;19:73-80.
- Timmer A, Behrens R, Buderus S, Findeisen A, Hauer A, Keller KM, et al. Childhood onset inflammatory bowel disease: predictors of delayed diagnosis from the CEDATA German-language pediatric inflammatory bowel disease registry. J Pediatr. 2011;158:467-73.e2.
- Mack DR, Langton C, Markowitz J, LeLeiko N, Griffiths A, Bousvaros A, et al. Laboratory values for children with newly diagnosed inflammatory bowel disease. Pediatrics. 2007;119:1113-9.
- Degraeuwe P, Beld M, Ashorn M, Canani RB, Day AS, Diamanti A, Fagerberg UL. Faecal calprotectin in suspected pediatric inflammatory bowel disease. J Pediatr Gastroenterol Nutr. 2015;60:339-46.
- Henderson P, Anderson NH, Wilson DC. The diagnostic accuracy of fecal calprotectin during the investigation of suspected pediatric inflammatory bowel disease: a systematic review and meta-analysis. Am J Gastroenterol. 2014;109:637-45.
- Van Rheenen PF, van de Vijver E, Fidler V. Faecal calprotectin for screnning of patients with suspected inflammatory bowel disease: diagnostic meta-analysis. BMJ. 2010;341:c3369.
- Medina Benítez E, Fuentes Lugo D, Suárez Cortina L, Prieto Bozano G. Enfermedad inflamatoria intestinal. En: Asociación Española de Pediatría [en línea] [consultado el 26/11/2015]. Disponible en: http://www.aeped.es/sites/default/files/documentos/eii.pdf


Envío de comentarios a los autores